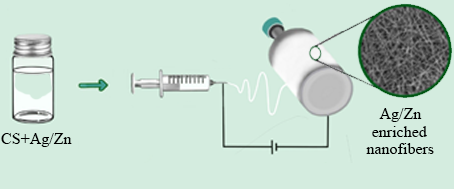
NanoMicrobiol NanoBiotechnol, 2022 (1), 202214
DOI: 10.52547/nanomicrob.2022.1.4
Review
Silver and zinc enriched chitosan nanofibers as an antimicrobial wound dressing
Zahra Asvar 1* and Esmaeel Mirzaee1
1 Department of Medical Nanotechnology, School of Advanced Medical Sciences and Technologies, Shiraz university of Medical Sciences, Shiraz, Iran
* Correspondence: z_asvar@yahoo.com
Abstract
Forty percent of the world’s 50 million annual deaths are due to infectious diseases caused by microorganisms, and the resistance of these pathogens to antibiotics has become a serious health problem. Wound dressing provides a protective barrier against the external factors and can accelerate the wound healing process. In recent years, the production of antibacterial wound dressings using nanofibers along with nanoparticles with antimicrobial properties for controlling infectious wounds has received much attention. Although various metal nanoparticles and metal oxides have been used for many applications so far, their use in biological systems is challenging due to their accumulation in the biological system. Excessive release or overexposure to these nanoparticles can also bring some devastating effects such as skin disease, allergies, cancer, prolonged wound healing, and prolonged tissue regeneration. Imbedding of nanoparticles in a nanofiber structure can solve these problems. In addition to antimicrobial properties, nanoparticles can increase the contact surface and porosity of the polymer substrate of the nanofibers. Wound healing and antibacterial properties of chitosan would make it a desirable choice for fabrication of antimicrobial wound dressings. Also, due to their strong antibacterial effect, silver and zinc nanoparticles are the best candidates to functionalize the chitosan fibers. Current paper has a review over the application of silver and zinc nanoparticles for the fabrication of antimicrobial wound dressing based on the chitosan nanofibers.
Keywords: Ag nanoparticles; Chitosan; Electrospinning; Nanofibers; ZnO nanoparticles
1 مقدمه
پوست گستردهترین و خارجیترین اندام انسان است که مانعی بین محیط داخل بدن و محیط اطراف در برابر ورود عوامل بیماریزا و از دست دادن آب فراهم میکند و وظایفی مهم مانند تنظیم دما، سنتز ویتامین D و غیره دارد (1, 2). بنابراین هرگونه آسیب جزیی یا گسترده به این ارگان پوششی میتواند موجب نقص در هموستازی و در نتیجه عملکرد اندامهای حیاتی گردد. از همین رو ضروری است که کلیهی آسیبهای وارده به ساختار پوست در اسرع وقت و با یک پانسمان مناسب پوشش داده شود (3). تخمین زده میشود که سالانه تقریباً 313 میلیون نفر در سراسر جهان از زخمهای ناشی از جراحی رنج میبرند و 76 میلیون نفر تحت زخمهای ناشی از عوارض دیابت، چاقی، بیماریهای قلبی عروقی و غیره قرار میگیرند (2). همچنین 40 درصد از 50 میلیون مرگ و میر سالانه در جهان به دلیل بیماریهای عفونی ناشی از میکروارگانیسمها مانند Escherichia coli، Pseudomonas aeruginosa ،Klebsiella pneumonia، Staphylococcus aureus است که مقاومت این عوامل بیماریزا در برابر آنتی بیوتیکها تبدیل به یک مشکل جدی بهداشتی شده است (4).
زخم به عنوان یک اختلال در یکپارچگی پوشش اپیتلیال و بافت مخاطی پوست تعریف میشود. با توجه به مدت زمان و ماهیت روند بهبودی، زخمها به دو دستهی حاد و مزمن طبقه بندی میشوند. زخم حاد در اثر آسیب مکانیکی ناشی از عوامل خارجی به وجود میآید که منجر به سایش بافت یا پارگی پوست میشود و پروسهی بهبودی آن 12-8 هفته به طول میانجامد (5). در مقابل، زخمهای مزمن که شایعترین نوع آنها زخمهای دیابتی هستند، مراحل عادی بهبودی زخم را طی نکرده و بهراحتی ترمیم نمیشوند (5, 6). زخمهای مزمن زمانی اتفاق میافتند که مکانیزمهای بهبودی طبیعی زخم در بدن به نحوی مهار یا مختل شوند و یا بافتهای آسیب دیده در معرض عوامل مضر محیطی قرار گیرند (7).
ترمیم زخم پاسخی اجباری به انواع محرکها است که بر پوست یا هر عضوی تأثیر میگذارند. فرایند ترمیم زخم شامل چهار مرحلهی هموستاز، التهاب، تکثیر و بازسازی است (8). ابتدا از سلولهای اطراف محل آسیب عوامل پیامرسانی ترشح میشوند که موجب کشاندن پلاکتها به سمت موضع زخم میشوند. با اتصال پلاکتها به اندوتلیوم آسیبدیده فرآیند هموستاز و انعقاد فعال شده، پلاکتها و فیبرین یک پلاک برای جلوگیری از خونریزی تشکیل میدهند (9). طی 48 ساعت پس از آسیب و در صورت توقف خونریزی، مرحلهی التهاب آغاز میگردد که میتواند سبب تسریع فرآیند بهبودی گردد. در این مرحله نوتروفیلها به عنوان اولین سلولهای جذب شده در محل ضایعه در از بین بردن عوامل خارجی و بافت آسیبدیده نقش دارند. سپس مونوسیتها به ماکروفاژها تمایز پیدا کرده و از بافتهای اطراف به فضای خارج عروقی مهاجرت میکنند (10). همچنین فیبروبلاستها در محل ظاهر شده و شروع به تولید رشتههایی فیبری از جنس بافت پیوندی میکنند که علاوه بر تامین استحکام کششی، بستری مناسب را جهت چسبیدن، رشد و تکثیر سلولها فراهم میکنند (11). در مرحله تکثیر، سیتوکینهای ضد التهابی و فاکتورهای رشد مختلف ترشح شده توسط ماکروفاژهای M2، تکثیر سلولی، رگزایی و تشکیل بافت گرانوله را تحریک میکنند. در ادامه، سلولهای اپیتلیال شروع به پر کردن فضای خالی در منطقه زیر ضایعه میکنند که نهایتا منجر به پر شدن محل ضایعه و بهبودی زخم میشود. در مرحلهی آخراز 2 تا 3 هفته پس از آسیب اولیه، بافت گرانوله به بافت اسکار بالغ تبدیل شده و مواد ماتریکس خارج سلولی مانند پروتئینهای فیبری، کلاژن، پلیساکاریدها، فیبرونکتین، گلیکوزآمینوگلیکانها و پروتئوگلیکانها بازسازی میشوند (12, 13). از این رو ترمیم زخم که توالی پویا و پیچیدهای است نیازمند محیطی مناسب است.
به طور کلی روشهای درمان زخم را میتوان به دو نوع عمده طبقه بندی کرد: روشهای سنتی (گاز، پنبه و بانداژ) که فقط زخم را از محیط خارجی جدا میکنند و دارای معایب متعددی همچون ایجاد خشکی سریع در بستر زخم، نشت اگزودا و عفونت زخم، واکنش التهابی بدن به الیاف پنبه و نیز آسیب رساندن به بافت گرانوله در هنگام برداشتن پانسمان هستند (7, 14). از روشهای پیشرفته که محیط ترمیم زخم را مرطوب نگه میدارند میتوان روش برداشتن بافت آسیب دیده یا عفونی (Debridement) ، درمان با استفاده از پلاسمای غنی از پلاکت (Platelet-rich plasma treatment) ، درمان با ایجاد خلاء منفی (Negative pressure wound therapy) ، سلول درمانی (Cell therapy) و استفاده از پوشش زخم (Wound dressing/healing) را نام برد (15).
پوشش زخم سدی محافظتی در برابر نفوذ عوامل خارجی فراهم میآورد که میتواند فرآیند ترمیم زخم را تسریع نماید. یک پوشش زخم ایدهآل باید دارای این خصوصیات باشد: تسهیل انتشار گازها و مواد غذایی، حفظ رطوب در سطح زخم، حذف سریع ترشحات زخم، ممانعت از ورود عوامل بیماریزا و همچنین تحویل کنترل شدهی عوامل درمانی (16). غیرسمی و غیرآلرژیک بودن، عدم چسبندگی به زخم و دارا بودن قابلیت جداسازی بدون ایجاد آسیب به بافت در حال ترمیم نیز ازجمله مهمترین خصوصیات ساختاری یک پوشش زخم ایدهآل به شمار میآیند (17).
امروزه توانایی ساخت پوششهای زخم در فرمهای گاز استریل، فیلم، هیدروژل، پوست فاقد سلول شده (Decellularized skin)، هیدروکلوئید، فوم و نانوفیبر وجود دارد (18). نانوفیبرها به دلیل شباهت به ماتریکس سه بعدی خارج سلولی پوست، ساختار متخلخل با منافذ کوچک که باعث تسهیل تبادل گازها و مواد مغذی، انتقال عوامل پیامرسان، تخلیه مایعات مترشحه از آن و در عین حال مانع از دست رفتن قطرات آب میشوند، انتخاب ایدهآلی برای پانسمان زخم هستند (2, 19). در عین حال ساختار درهم پیچیدهی شبکهی نانوفیبری و اندازهی حفرات آن اجازهی رسیدن میکروارگانیسمها به سطح زخم را نمیدهد. درنتیجه احتمال ایجاد طیف گستردهای از عفونتهای باکتریایی، قارچی و ویروسی تا حد قابل توجهی کاهش خواهد یافت (20, 21). همچنین ایجاد سطح واکنشپذیری بالای این داربستها برای بارگذاری و تحویل دارو، مولکولهای زیستی و نانوذرات مساعد است که این ویژگیها، نانوفیبرها را به گزینهی مناسبی جهت استفاده در انواع پوششهای زخم تبدیل میکند (19, 22).
روش های متعددی برای تولید نانوفیبرها پیشنهاد شده است که اصلیترین آنها عبارتند از کشیدن (Drawing) ، خود آرایی (Self-assembly) ، جدایی فاز (Phase separation) ، استفاده از الگو (Template synthesis) و الکتروریسی (Electrospinning) (23).
الکتروریسی روشی برای تولید فیبر در مقیاس نانو و با استفاده از نیروی الکترواستاتیک است که از اوایل دههی 1930 شناخته شد، اما تا دههی 1990، زمانی که ثابت شد تعداد زیادی از پلیمرهای آلی قابلیت الکتروریسی با اندازههای نانومتری را دارند، مورد توجه قرار نگرفته بود (24). بهطور عمده امروزه نانوفیبرها از طریق تکنیک الکتروریسی تولید میشوند که روشی ساده، مقرون به صرفه، تکرارپذیر و با تنوع بالا در انتخاب مواد اولیه و کنترل روی محصول نهایی با تقلید عالی از ماتریکس خارج سلولی است (25). در واقع ماتریکسهای نانوفیبری الکترواسپان به دلیل جذب ترشحات اضافی از روی زخم، امکان تبادل گازهای تنفسی و بخار آب، فراهم نمودن محیطی مرطوب بر روی زخم، ممانعت از ورود باکتریها و قارچها به زخم، بهبود زخم را تسریع مینمایند. این امر موجب شده تا در سالهای اخیر جهت استفاده به عنوان پوششهای زخم و پانسمان مورد توجه ویژهای قرار گرفتهاند. فراهم بودن امکان تولید این دسته از پانسمانها در مقیاس صنعتی میتواند دلیل دیگری برای توجه ویژه به این روش در تولید نانوفیبرها باشد. فراهم بودن امکان تولید این دسته از پانسمانها در مقیاس صنعتی میتواند دلیل دیگری برای توجه ویژه به این روش در تولید نانوفیبرها باشد (26).
نانوفیبرهای الکتروریس دارای کاربردهای فراوانی در شاخههای مختلف الکترونیک، فیلترهای تصفیه، کاتالیزورهای بر پایه نانوفیبر، سنسورهای مبتنی بر نانوفیبر و همچنین حوزهی زیست پزشکی هستند. عمده کاربردهای نانوفیبرهای الکتروریس در حوزهی زیست پزشکی در چهار شاخهی اصلی دارورسانی، انتقال ژن، مهندسی بافت و پوششهای زخم دستهبندی میشود (27).
2 فناوری الکتروریسی
در طی فرایند الکتروریسی ولتاژ اعمال شده به سیال پلیمری باعث نفوذ بارهای الکتریکی به درون سیال میشود. با رسیدن این بارها به یک مقدار بحرانی، یک قطره از محلول پلیمری که به وسیلهی کشش سطحی خود در نوک سوزن نگه داشته شده است به سمت الکترود مقابل کشیده میشود. در اثر پرواز این باریکهی پلیمری (Polymeric jet) مابین نازل و جمعکننده، حلال موجود در جت پلیمری تبخیر شده و نانوفیبرهای حاصل بر روی سطح جمعکننده تشکیل میشوند (28). بهطور کلی پارامترهای موثر بر الکتروریسی را به سه دسته تقسم بندی میکنند که هر کدام از آنها به صورت جداگانه و یا به صورت متقابل با یکدیگر بر روی فرآیند الکتروریسی و تولید فیبرهای الکتروریس تاثیر میگذارند. این پارامترها را میتوان به سه دسته طبقه بندی کرد. اول پارامترهای وابسته به محلول، اصلیترین عوامل این پارامترها عبارتند از ویسکوزیتهی محلول، غلظت محلول، رسانایی الکتریکی محلول، کشش سطحی محلول، ممان دوقطبی محلول، فراریت محلول و وزن مولکولی پلیمر. دوم پارامترهای وابسته به محیط، از جمله مهمترین این پارامترها میتوان به دما، رطوبت و اتمسفر محیط اشاره کرد. ونهایتا سومین پارامتر، پارامترهای وابسته به دستگاه هستند که عبارتند از ولتاژ میدان، نرخ تغذیه، فاصلهی بین نازل تا جمعکننده و نوع جمعکننده.
جهت کاربرد پانسمان زخم، علاوه بر ساختار نانوفیبرها، نوع مواد سازنده این ساختارها نیز از اهمیت ویژهای برخوردار است. این مواد پلیمری میتوانند از جنس پلیمرهای طبیعی، پلیمرهای سنتزی و یا ترکیبی از هردو نوع باشند (29). تا به امروز طیف گستردهای از پلیمرهای طبیعی در تولید پانسمانهای نانوفیبری الکتروریس مورد استفاده قرار گرفتهاند. از جمله شناختهشدهترین پلیمرهای مورد استفاده در پانسمان زخم میتوان به آلژینات، ژلاتین، سلولز، کلاژن، کراتین، فیبروین ابریشم، اسید هیالورونیک و کیتوزان اشاره کرد. پلیمرهای طبیعی به دلیل دارا بودن جایگاههای اتصال به سلول بر روی زنجیرهی خود، ویژگیهای ایدهآل زیستی مانند تقویت اتصال، رشد و تکثیر سلولها و نیز سمیت پایین را ارائه میدهند. همچنین شباهت ساختاری این پلیمرها به ماتریکس خارج سلولی طبیعی پوست موجب تسریع روند بهبود زخم میشود (29, 30).
3 کیتوزان
کیتوزان (Chitosan, CS) یک پلیساکارید خطی با منشا طبیعی و محتوای نیتروژن بالاست که از واحدهای ساختاری ان-استیلگلوکزامین (N-Acetylglucosamine) و دی-گلوکزآمین (D-glucosamine) تشکیل شده است. وزن مولکولی آن بهطور معمول 300 تا 1000 کیلودالتون است که وابسته به منبعی است که کیتوزان از آن به دست آمده است. کیتوزان در طبیعت به مقدار بسیارکم و فقط در برخی قارچها یافت میشود، کیتوزان مورد استفاده در صنعت و کاربردهای تحقیقاتی از کیتین و پس از انجام فرآیندهای شیمیایی یا آنزیمی بر روی سختپوستان بهدست میآید. در واقع این پلیمر طی فرایند هیدرولیز در یک محلول قلیایی در دمای140-80 درجهی سانتی گراد و طی مدت زمان ده ساعت، از داستیله شدن کیتین به دست میآید (31). در طی این فرایند ساختار استیل از تعدادی از گروههای استامید موجود در زنجیره پلیمری حذف میشود. به این فرآیند که منجر به ایجاد دو مونومر (N-acetyl-D-glucosamine) و (D-glucosamine) در ساختمان پلیمر کیتین میشود استیلزدایی میگویند. در صورتیکه درجهی استیلزدایی بیش از 50 درصد باشد، کوپلیمر حاصل را کیتوزان مینامند (32).
خصوصیات فیزیکوشیمیایی کیتوزان رابطهی تنگاتنگی با وزن مولکولی و درجهی استیلزدایی آن دارد. گروههای عاملی که در ساختار این پلیمر حضور دارند (هیدروکسیل، آمین و کربوکسیل) این پلیمر را به یک پلیمر حساس به pH تبدیل کرده است، بدین معنا که در pHهای زیر pH فیزیولوژیک، گروههای عاملی آمین سطح کیتوزان پروتونه شده و ساختارهای پایهی کیتوزان به بیوپلیمرهای کاتیونی با چگالی بار بالا تبدیل میشوند. این ویژگیهای منحصر به فرد ساختاری موجب شده است که کیتوزان خواص ساختاری، مکانیکی و زیستی مطلوبی را نشان دهد. از جمله مهمترین این خصوصیات میتوان به آبدوستی بالا، عدم ایمنیزایی، آنتیباکتریال بودن، زیستسازگاری بالا، زیستتخریبپذیری سریع و لختهکنندگی خون اشاره کرد (33). علاوه بر ویژگی ضدقارچی و آنتیباکتریال کیتوزان، تقویت چسبندگی، رشد سلولی و نیز نفوذپذیری بالا نسبت به اکسیژن، این پلیمر را به گزینهی مطلوبی جهت کاربردهای پزشکی تبدیل کرده است. یکی از منحصر بهفردترین خواص کیتوزان این است که این پلیمر به تدریج دپلیمریزه میشود و گروههای (N-acetyl-D glucosamine) از ساختار آن آزاد میشوند. این گروهها میتوانند موجب شروع تکثیر فیبروبلاستها، جلوگیری از رسوب بیش از اندازه کلاژن و همچنین افزایش سطح سنتز هیالورونیک اسید در محل زخم گردند. درنهایت کلیهی موارد مذکور میتوانند موجب تسریع بهبودی زخم و پیشگیری از تشکیل بافت اسکار شوند (34). از اینرو نانوفیبرهای بر پایهی کیتوزان همواره به عنوان گزینهای ایدهآل جهت استفاده در کاربردهای پزشکی و تولید پانسمان زخم در نظر گرفته میشوند.
قابلیت الکتروریسی کیتوزان عمدتاً به دلیل ماهیت پلیکاتیونی آن در محلول، ساختار شیمیایی سخت D-گلوکز آمین و برهمکنشهای خاص بین مولکولی و درون مولکولی این پلیمر محدود است. تشکیل پیوندهای هیدروژنی قوی مانع از حرکت آزاد بخشهای زنجیری پلیمری در معرض میدان الکتریکی شده و منجر به شکستن جت پلیمری در طول فرآیند میشود. علاوه بر این انتظار میرود که نیروی دافعهی میان گروههای یونی روی زنجیره مانع درهمتنیدگیهای کافی برای تشکیل فیبر پیوسته و ایجاد نانوذرات به جای نانوالیاف شود (35, 36). از طرفی ماهیت پلیالکترولیتی کیتوزان باعث افزایش کشش سطحی محلول و در نتیجه نیاز یه ولتاژ بالا برای تولید نانوفیبر از آن میشود. نانوفیبرهای تولیدی نیز به علت حضور مقادیر بالای بارهای مثبت به شکل مارپیچهای بسیار منقبض درمیآیند (37).
موفقترین و سادهترین روش به منظور بهبود الکتروریسی کیتوزان، ترکیب آن با فاز دوم پلیمر سنتزی یا طبیعی است. این عامل همریسی معمولاً پلیمری است که به راحتی الکتروریسی میشود، مانند پلیاتیلن اکسید (Poly(ethylene oxide), PEO)، پلیوینیل الکل (Poly(vinyl alchohol), PVA)، پلیلاکتید اسید (Polylactic Acid, PLA)، پلیآکریل آمید(Polyacrylamid, PAM) یا کوپلیمرهای آنها، فیبروئین ابریشم و کلاژن، که همگی زیستسازگار و زیستتخریبپذیر هستند و کاربرد نهایی نانوالیاف کیتوزان را محدود نمیکنند (35).
یکی از پلیمرهای سنتزی پرکاربرد در زمینهی پزشکی پلیاتیلن اکسید است که پلیمری زیست سازگار، غیرسمی و خنثی است. این پلیمر سنتزی میتواند با کیتوزان تعامل داشته باشد تا ظرفیت حمل بار مخلوط الکتروریسی را بهبود بخشد. موفقیت الکتروریسی CS-PEO نتیجهی ایجاد پیوندهای هیدروژنی بین گروههای اتر در PEO و گروههای هیدروکسیل و آمین در CS است (35). PEO همچنین ویسکوزیتهی محلولهای بسیار غلیظ CS را کاهش داده و هنگام مخلوط شدن با آن یک ترکیب پلیمری غیرکوالانسی و یکنواخت ایجاد میکند (38).
4 زخمپوشهاي ضدباکتریایی
در سالهاي اخير توليد زخمپوشهاي ضدباکتري با استفاده از نانوالیاف طبیعی و سنتزی به همراه نانوذراتی همچون طلا، نقره، اکسید روی، اکسید مس، اکسید تیتانیوم و اکسید آهن براي کنترل زخمهاي عفوني مورد توجه زیادی قرار گرفته است. برای جلوگیری از عفونتهای باکتریایی، یک ماده ضدباکتری مناسب با کمترین اثرات مخرب و خواص ضدباکتری پایدار برای طیفی وسیع از باکتریها، گزینه ایده آلی خواهد بود.
نانوذرات نقره از شناختهشدهترین و پرکاربردترین نانوذرات دارای خاصیت ضدمیکروبی هستند. پانسمانهای مبتنی بر نانوذرات نقره حتی در صورت استفاده طولانی مدت آبسه ایجاد نمیکنند. هنگام ترکیب شدن این نانوذرات با کلاژن فعالیت ضد باکتریایی قوی ایجاد میشود. از طرفی این نانوذرات دارای ویژگی ضدباکتریایی عالی برای طیف گستردهای از باکتریها از جمله سویههای مقاوم در برابر آنتیبیوتیک هستند. این خصوصیات نانوذرات نقره را به یک جزء مناسب برای پانسمان زخم تبدیل میکند (39, 42). در شرایط درونتنی، محیط اسیدی اکسیداسیون نانوذرات نقره به یونهای نقره را تسهیل میکند. یونهای نقره تولید شده مسئول فعالیت ضد میکروبی با آسیب رساندن به دیوارهی سلولی، DNA و زنجیرهی تنفسی هستند که با این کار باعث مهار تولید آدنوزین تریفسفات، تولید گونههای فعال اکسیژن، ایجاد اختلال در تقسیم سلولی و در نهایت مرگ سلول باکتریایی میشود (43).
اکسید روی (ZnO) یک عامل ضد باکتریایی غیرآلی است که برای التیام زخمها به ویژه بهبود زخمهای مزمن و سوختگی کاربرد زیادی دارد. استفاده موضعی روی برای کاهش التهاب، بهبود اپیتلیال شدن مجدد و کاهش رشد باکتری در زخمها گزارش شده است. روی، به عنوان کوفاکتور متالوپروتئیناز، همچنین نقش حیاتی در بازسازی ماتریکس خارج سلولی ایفا میکند. اثر ترمیم زخم نانوذرات اکسید روی بر اساس اندازه و غلظت نانوذرات است. نانوذرات اکسید روی به دلیل اندازهی کوچک و نسبت سطح به حجم بالا، فعالیت ضد باکتریایی بسیار بیشتری دارد. علاوه بر این به عنوان یک تنظیم کننده برای مهاجرت کراتینوسیت و اتوفاگوسیتوز عمل میکند که برای ترمیم طبیعی زخم بسیار مهم هستند (44). زمانی که یونهای روی آزاد شده از نانوذرات با مایعات بیولوژیکی برخورد میکنند، تحت هیدراتاسیون سریع قرار و اکسید روی هیدراته تشکیل میشود که یک عامل باکتریکش قوی است (45).
خواص نانوذرات به شدت به اندازه، شکل و مورفولوژی آنها بستگی دارد. از اینرو ساخت کنترل شدهی نانوذرات، فناوری نانو را به یکی از امیدوارکنندهترین و محبوبترین زمینههای تحقیقات علمی امروز تبدیل کرده است که پیشرفت آن مستلزم توانایی تهیهی نانومواد به صورت قابل تکرار و کنترل شده است. از جمله روشهاي متداول و پرکاربرد جهت سنتز نانوذرات با امکان کنترل اندازه، ساختار کريستالي و يکنواختي آنها ميتوان به روشهاي شيميايی مانند سل-ژل، رسوب دهی شیمیایی، روش هیدروترمال، پیرولیز و احیای شیمیایی اشاره کرد (46, 47).
احیای شیمیایی روش سنتز پایین به بالا است که برای سنتز نانوذرات فلزی کاربرد زیادی دارد. این روش آسان، مقرون به صرفه و کارآمد است و میتوان با بهینه سازی عوامل تجربی، به عنوان مثال نسبت مولی تثبیت کننده یا عامل احیا کننده به نمک فلزی پیشساز، پراکندگی سایز و اندازهی نانوذرات را کنترل کرد (48, 49).
اگرچه تاکنون از نانوذرات مختلف فلزی و اکسید فلزی برای کاربردهای زیادی استفاده شده است، اما به دلیل تجمع آنها در سیستم بیولوژیکی و لزوم جداسازی نهایی، استفاده از آنها در سیستمهای بیولوژیکی با چالش همراه است (50). همچنین آزاد سازی بیش از حد یا قرار گرفتن زیاد در معرض این نانوذرات میتواند اثرات مخربی مانند بیماری پوستی آرگیریا، آلرژی و سرطان ایجاد کند و مدت زمان ترمیم زخم و بازسازی بافت را طولانی نماید (51). با قرار دادن این نانوذرات در ساختارهای نانوالیاف میتوان این مشکل را حل کرد و علاوه بر استفاده از خاصیت آنتیباکتریال نانوذرات، موجب افزایش سطح تماس و تخلخل بستر پلیمری حاصل شد. در این صورت یونهای آزاد شده از نانوذرات در معرض سلولهای میکروارگانیسم قرار گرفته و اثر ضدمیکروبی خود را اعمال میکنند، هرچند امکان رها شدن نانوذره از ساختار نانوفیبر و ورود آن به سلول باکتری نیز وجود دارد (52).
از این رو میتوان نتیجه گرفت که کامپوزیتهای نانوالیاف الکتروریس کیتوزان به همراه نانوذرات نقره و کیتوزان به همراه نانوذرات روی به دلیل پتانسیل ضدمیکروبی و بهبود رسوب کلاژن در ناحیهی زخم، می توانند نامزدهای امیدوار کنندهای برای کاربردهای ترمیم زخم باشند. در ادامه مروری بر مطالعات صورت گرفته در این حیطه خواهیم داشت.
5 نانوذرات فلزی و اکسید فلزی
همانطور که گفته شد نانوذرات فلزی و اکسید فلزی دارای خاصیت آنتیباکتریایی قوی در برابر باکتریهای گرم مثبت و گرم منفی میباشند. در ادامه به بررسی برخی پژوهشهای انجام شده در این زمینه میپردازیم.
5.1 نانوذرات نقره
نانوذرات نقره محبوبترین نانوذراتی هستند که به عنوان عوامل ضدمیکروبی استفاده میشوند. این نانوذرات و ترکیباتی که بر اساس آن ساخته میشوند دارای خاصیت ضدباکتری بسیار قوی در برابر اکثر گونههای باکتری، حتی در غلظتهای کم مورد استفاده میباشند. از طرفی پلیمر کیتوزان به دلیل ویژگی منحصر به فرد کاتیونی-پلی الکترولیت و توانایی تشکیل ژل میتواند یونهای فلزی را از طریق جاذبهی الکترواستاتیکی جذب کند. بر این اساس آن و همکارانش در سال 2009 موفق به الکتروریسی محلولهای CS/PEO حاوی کلوئیدهای نقره و با استفاده از احیای شیمیایی درجای (in situ) یونهای نقره شدند. طیفسنجی اشعه ایکس نشان داد که وجود پیوند Ag-O در الیاف کامپوزیتی منجر به ترکیب تنگاتنگ بین نقره و کیتوزان شده است. ارزیابی فعالیتهای ضدمیکروبی غشاهای نانوفیبری علیه باکتری E. coli نیز نشان داد که حضور نانوذرات نقره در الیاف به طور قابل توجهی منجر به غیرفعال شدن باکتریها میشوند (53). در پژوهشی دیگر داربست نانوفیبری پلی وینیلیدین فلوراید حاوی نانوذرات نقره تهیه شد و فعالیت ضد باکتریایی آن در برابر باکتریهای
S. aureusو K. pneumoniae مورد بررسی قرار گرفت. نتایج حاصل نشان داد که داربستهای حاوی نانوذرات نقره فعالیت ضد باکتریایی بیشتری در مقایسه با نانوفیبرها از خود نشان دادند (54).
اخیراً الکتروریسی چند نازله به عنوان یک روش عالی برای ساخت مواد هیبریدی با خواص بهبود یافته، با بهرهوری از خواص هر یک از پلیمرها به صورت جداگانه معرفی شده است. از پژوهشهای انجام شده درد این زمینه میتوان به ساخت داربستی از نانوالیاف هیبریدی و دووجهی از جنس پلیمرهای پلیاورتان وPEO اشاره کرد. برای این منظور نمک نیترات نقره در محلول PEO با وزن مولکولی بالا احیا شده و متعاقباً بسته به زمان احیا، نانوذرات بر روی سطح نانوالیاف PEO تشکیل شدند. در واقع پلیمر PEO هم به عنوان عامل کاهنده و هم به عنوان بستری برای تشکیل AgNPs مورد استفاده قرار گرفت. این پانسمان فعالیت ضد باکتریایی قوی را در برابر E. coli و کاربردهای ترمیم زخم از خود نشان داد (55).
این نانوذره همچنین برای کاربرد تصفیهی آب و هوا نیز مورد استفاده گرفته است. برای این هدف سنتز درجای نانوذره در پلیمر نایلون و به وسیلهی احیاکنندهی سدیم بروهیدرید و نمک نقره انجام شد و خواص ضد باکتریایی نانوالیاف در برابر باکتری E. coli و S. aureus مورد بررسی قرار گرفت که نتایج قابل قبولی را از خود نشان داد (56).
گروهی دیگر از پژوهشگران با استفاده از تکنیک الکتروریسی یک پانسمان زخم از جنس نانوالیاف CS/PEO حاوی AgNPs طراحی کردند. نانوذرات به طور مستقیم در محلول پلیمری با استفاده از روش احیای شیمیایی تولید شدند. نتایج آزمایش ضد باکتری بر روی میکروارگانیسمهای P. aeruginosa و (Methicillin-Resistant Staphylococcus Aureus, MRSA) نشان داد که این کامپوزیت میتواند در درمان موضعی زخمهای عفونی موثر باشد (57).
در یک پژوهش که توسط لی صورت گرفت کیتوزان به عنوان عامل کاهنده و تثبیت کنندهی نیترات نقره استفاده شد نانوالیاف حاصل مقاومت کششی بالا، سازگاری بسیار خوب و فعالیت ضد باکتریایی عالی در برابر باکتری های گرم مثبت و گرم منفی از خود نشان دادند (58).
همچنین گروهی از محققان در سال 2015 موفق به الکتروریسی نانوالیاف کیتوزان به ترتیب با PEO و نمک نیترات نقره، به عنوان پلیمر همریس (Coectrospinning) و پیش ساز نانوذرات نقره شدند. سپس از پلاسمای آرگون برای حکاکی سطحی و سنتز نانوذرات استفاده شد. بمباران سطحی پلاسما باعث ایجاد نانوذرات بر روی سطوح نانوالیاف کیتوزان از طریق اتصال این نانوذرات به گروههای آمین موجود در کیتوزان شد. مطالعات انجام شده بر روی میکروارگانیسم E. coli نشان داد که فعالیت ضدباکتریایی نانوالیاف حاوی نانوذرات نقره سنتز شده با پلاسما افزایش یافته است (61).
از پژوهشهای دیگری که بر روی این نانوذره در زمینهی نانوفیبرهای الکتروریس انجام شده میتوان به مطالعهی یانگ بر سنتز نانوالیاف پلی وینیل الکل حاوی نانوذرات نقره بر علیه میکروارگانیسمهای S. aureus و E. coli (62) یا تلاش آکتورک در جهت همین سنتز و با استفاده از نشاسته به عنوان عامل احیاکننده اشاره کرد داد (63).
اخیرا نیز گروهی از پژوهشگران ترکیبی از نانوالیاف ضد باکتری، متشکل از استات سلولز، پلیاتیلنگلیکول و نانوذرات نقره را با روش الکتروریسی ساختند. این مطالعه یک روش آسان به منظور ترکیب نانوذرات نقره در بستر نانوالیاف با احیای درجای نمک نیترات نقره ارائه داد. پلیاتیلنگلیکول نه تنها به عنوان عامل احیا کننده برای کاهش نانوذرات عمل کرد، بلکه جذب آب از داربست نانوفیبری استات سلولز را تا 95 درصد افزایش داد. این خاصیت موجب افزایش توانایی جذب بیشتر ترشحات در ناحیهی زخم شد. همچنین داربست حاصل اثر ضدباکتریایی رضایت بخشی را در برابر باکتریهای E. coli و S. aureus نشان داد (69).
5.2 نانوذرات اکسید روی
ایمنی و سازگاری اکسیدروی با پوست انسان، آن را به افزودنی مناسب برای منسوجات و سطوحی که با بدن انسان در تماس هستند تبدیل کرده است. از اینرو در یک کار تحقیقاتی ارزیابی مورفولوژیکی، مکانیکی و ضد باکتریایی داربستهای نانوکامپوزیتی مبتنی بر نانوالیاف پلیلاکتید با غلظتهای مختلف نانوذرات اکسید روی به عنوان پانسمان زخم ضد میکروبی مورد بررسی قرار گرفت. این داربست با دو تکنیک متفاوت، یعنی الکتروریسی و ترکیبی از الکتروریسی محلول پلیمری با الکتروپاشی نانوذرات ساخته شد. حضور نانوذرات چقرمگی داربست را افزایش داد و در غلظت بهینه (3 درصد وزنی) استحکام کششی و مدول یانگ بهبود یافت. همچنین غلظت نسبتاً کم نانوذرات باعث مهار رشد باکتریهای S. aureus و E. coli شد (59). در مطالعهای دیگر که در سال 2014 بر روی این نانوذره صورت گرفت، مطالعهی آگوستین و همکاران وی بود که اثر نانوذرات اکسید روی را بر قطر، مورفولوژی، فعالیت ضد باکتریایی و تکثیر سلولی پلیکاپرولاکتون الکتروریس بررسی نمودند. این مطالعه نشان دهندهی افزایش پایداری مکانیکی، خواص ضد باکتریایی، تکثیر فیبروبلاست و بهبود فعالیت متابولیکی سلولها بود. این اولین گزارش در مورد توانایی یک ماده زیستی حاوی نانوذرات اکسید روی برای افزایش تکثیر سلولی بود (60).
گروهی دیگر از محققان در سال 2018 نانوذرات اکسید روی و استات روی را در نانوالیاف پلیکاپرولاکتون تعبیه کردند تا پانسمانهای زخم نانوکامپوزیتی ضد باکتری بر علیه باکتریهای E. coli و S. aureus ایجاد کنند. اثر اشعهی فرابنفش بر فعالیت ضد باکتریایی داربستها نیز در این پژوهش مورد مطالعه قرار گرفت. نتایج نشان داد که این داربستها به طور همزمان با دو مکانیسم اصلی ضد باکتریایی از رشد سلولهای پلانکتونی و بیوفیلم باکتری جلوگیری میکنند: انتشار یونهای روی (عمدتا از نانوذرات استات روی) و فرآیندهای اکسیداتیو فوتوکاتالیستی که توسط نانوذرات اکسید روی اعمال می شود. خواص ضد باکتریایی نمونهها نیز با قرار گرفتن در معرض اشعهی فرابنفش به طور قابل توجهی افزایش یافت (66).
از دیگر پژوهشها بر روی این نانوذره میتوان به عاملدار کردن سطح غشای داربست نانوفیبری پلیآکریلونیتریل با نانوذرات نقره-اکسید روی اشاره کرد. این کار با سه روش شیمیایی رفلاکس، ترکیب و هیدروترمال انجام شد. نانوکامپوزیتهای حاصل نسبت به همتایان تک جزیی خود خواص ضد باکتریایی عالی در برابر باکتری های E. coli و میکروکوکوس لوتئوس (Micrococcus luteus) نشان دادند. بنابراین این مطالعه رویکردی ساده و مقرون به صرفه را برای توسعه غشای عملکردی ضد باکتریایی نشان داد که کاربردهای بالقوه زیادی در صنایع تصفیه آب و هوا، ماسک، نساجی و بستهبندی دارد (68).
باقری و همکارانش در سال 2021 با استفاده از تکنیک الکتروریسی نانوفیرهایی از جنس پلیمرهای کیتوزان و PEO را به همراه نانوذرات نقره و روی جهت کاربرد پانسمان زخم سنتز کردند که دارای اثر آنتی اکسیدانی و فعالیت ضدباکتریایی بالایی در برابر E. coli، S. aureus و P. aeruginosa بود. این نانوکامپوزیت بر اساس نتایج سلولی هیچ سمیتی بر روی سلولهای فیبروبلاست نداشت. همچنین سازگاری خونی مناسب و مهاجرت و تکثیر سلولی قابل توجهی را در حاشیهی زخم نشان داد (70).
5.3 نانوذرات طلا
نانوذرات طلا به دلیل غیرسمی بودن، توانایی عاملدار کردن، سهولت تشخیص و فعالیت فتوترمال، در توسعه عوامل ضد باکتریایی بسیار ارزشمند هستند. اگرچه تولید ROS عامل اصلی مرگ سلولی برای اکثر آنتیبیوتیک ها و مواد ضدباکتری است، فعالیت ضدمیکروبی نانوذرات طلا هیچ مرتبط با ROS نیست. کوی و همکارانش ثابت کردند که فعالیت ضد میکروبی این نانوذرات به اتصال آنها به غشای باکتری و به دنبال آن کاهش سطح ATP و همچنین مهار اتصال tRNA به ریبوزوم مربوط میشود (71).
یانگ و همکارانش در سال 2017 از یک مولکول کوچک آمینوپنی سیلانیک اسید با پوشش نانوذرات طلا بر روی نانوالیاف الکتروریس پلیکاپرولاکتون جهت مهار باکتریهای مقاوم به چند دارو (Multiple Drug Resistance, MDR) استفاده کردند. نمونه حاصل در مواجهه با باکتریهای MDR فعالیت ضد باکتریایی قابل توجهی از خود نشان داد. این نانوساختار همچنین دارای سازگاری زیستی بالایی بود. بررسیهای درونتنی نیز توانایی درمان عفونت زخم باکتری MDR با این نانوساختار را تایید کرد (65)
5.4 نانوذرات مس
نانوذرات مس به دلیل خواص بیولوژیکی، شیمیایی و فیزیکی منحصر به فرد، فعالیتهای ضد میکروبی و همچنین هزینهی پایین آمادهسازی مورد توجه دانشمندان قرار گرفته است. بر این اساس گروهی از محققان نانوالیاف هیبریدی از جنس کیتوزان، پلیوینیل الکل و نانوهیدروکسی آپاتیت را با ترکیب نانوذرات نقره و مس برای پانسمان زخم تهیه کردند. نانوذرات بارگذاری شده روی نانوالیاف به روش درجا و با ایجاد پیوند شیمیایی هیدروکسیل با نانوالیاف ایجاد شدند. نتایج برونتنی نشان داد که کامپوزیت حاصل نمونهی مناسبی برای کاربرد پانسمان زخم بوده زیرا دارای ناحیه بازدارندگی بسیار خوبی در برابر باکتریهای گرم منفی و گرم مثبت بودند. این کامپوزیت همچنین دارای زیست سازگاری خوب و عدم سمیت سلولی بود (67).
5.5 نانوذرات آلومینا
در مطالعهای که در سال 2009 انجام شد نشان داده شد که این نانوذرات فقط در غلظتهای بسیار بالا دارای اثر بازدارندگی متوسط بر روی باکتری E. coli بوده است. در واقع این نانوذره دارای فعالیت مهار رادیکالهای آزاد است که به موجب آن مانع تخریب دیواره سلولی و اثرات ضدمیکروبی قوی میشود (72). اگرچه در مطالعهای دیگر استفاده از این نانوذره در بستر نانوالیاف پلی وینیل پیرولیدون بر علیه دو سویهی باکتری E. coli و S. aureus رضایتبخش بود. مدل برونتنی ترمیم زخم سوختگی با استفاده از این نانوکامپوزیت نیز با تسهیل اپیتلیالسازی مجدد و همچنین سنتز کلاژن روند بهبود زخم را تسریع کرد (73).
5.6 نانوذرات آهن
از بین نانوذرات اکسید آهن، نانوذرهی مگنتیت (Fe3O4) به دلیل خصوصیات منحصر به فردی همچون خواص نوری، الکتریکی، انتقال وابسته به اسپین، سمیت پایین و زیستسازگاری بالا بیشتر مورد توجه پژوهشگران است. در پژوهشی که توسط نینگ و همکارانش صورت گرفت از نانوذرات مغناطیسی مگنتیت به منظور بهبود خواص مکانیکی و ضدمیکروبی نانوالیاف کامپوزیتی کیتوزان/ژلاتین جهت استفاده به عنوان پانسمان زخم استفاده شد. حضور این نانوذرات در نانوفیبر منجر به افزایش قابل توجه خواص مکانیکی شد به طوریکه غشای نانوالیاف حاوی یک درصد وزنی نانوذره به 155 درصد افزایش مدول یانگ، 128 درصد افزایش استحکام کششی و 100 درصد افزایش چقرمگی دست یافت. علاوه بر این، ناحیهی بازدارندگی برای S. aureus و E. coli به طور قابل توجهی گسترش یافت (74).
در پژوهشی دیگر نسبتهای وزنی مختلف نانوکامپوزیت Fe3O4@Cs@Ag در پلیمر پلیوینیلپیرولیدون اضافه شده و از طریق فرآیند الکتروریسی نانوالیاف مغناطیسی با خاصیت ضدمیکروبی ساخته شدند. نتایج این مطالعه نشان داد که غشاهای نانوفیبری تولید شده در مقابل طیف وسیعیع از باکتریهای مورد آزمایش فعالیت ضد باکتریایی بسیار خوبی از خود نشان دادند (75).
5.7 نانوذرات تیتانیوم
تابش اشعهی ماورابنفش به نانوذرات دیاکسیدتیتانیوم سبب تولید رادیکالهای هیدروکسیل، یونهای سوپراکسید و تجزیهی ترکیبات آلی میشود. از اینرو این نانوذرات در حضور اشعهی فرابنفش میتوانند به عنوان یک نانوذره ضدمیکروبی عمل کنند. در پژوهشی داربست الکتروریسی شده پلیآکریلونیتریل حاوی نانوذرات تیتانیا و با استفاده از عامل احیاکنندهی پلی دوپامین هیدروکلراید سنتز شد. مشاهده شد که این نمونه قادر به مهار رشد باکتریهای E. coli و S. aureus تا 120 ساعت میباشد (76).
در مطالعهای دیگر این نانوذرات در نانوفیبرهای الکتروریسی شدهی پلیلاکتیک اسید قرار داده شده و تحت تابش ماورابنفش قرار گرفتند. نتایج حاصل نشان دهندهی فعالیت ضدمیکروبی مطلوب این نانوکامپوزیت بر روی سویههای S. aureus و E. coli بود (77).
تشکر و قدردانی
این مقاله تحت حمایت دانشگاه علوم پزشکی شیراز به نگارش درآمده است. و نویسندگان اعلام میدارند که در مطالب ارائه شده هیچ گونه سوگیری وجود ندارد.
منابع
1. Weiser TG, Haynes AB, Molina G, Lipsitz SR, Esquivel MM, Uribe-Leitz T, et al. Size and distribution of the global volume of surgery in 2012. Bull World Health Organ. 2016;94:201-209.
2. Dong Y, Zheng Y, Zhang K, Yao Y, Wang L, Li X, et al. Electrospun nanofibrous materials for wound healing. Adv Fiber Mater. 2020;2:212-27.
3. Dhivya S, Padma VV, Santhini E. Wound dressings–a review. BioMedicine. 2015;5:24-8.
4. Moustafa MT. Removal of pathogenic bacteria from wastewater using silver nanoparticles synthesized by two fungal species. Water Sci. 2017;31:164-76.
5. Dhivya S, Padma VV, Santhini E. Wound dressings – a review. Biomedicine (Taipei). 2015;5:22. DOI: 10.7603/s40681-015-0022-9.
6. Patrulea V, Ostafe V, Borchard G, Jordan O. Chitosan as a starting material for wound healing applications. Eur J Pharm Biopharm. 2015;97:417-26.
7. Gizaw M, Thompson J, Faglie A, Lee SY, Neuenschwander P, Chou SF. Electrospun Fibers as a Dressing Material for Drug and Biological Agent Delivery in Wound Healing Applications. Bioengineering (Basel). 2018;5. DOI:10.3390/bioengineering5010009.
8. Singer AJ, Clark RA. Cutaneous wound healing. N Engl J Med. 1999;341:738-46.
9. Hickman DA, Pawlowski CL, Sekhon UD, Marks J, Gupta AS. Biomaterials and advanced technologies for hemostatic management of bleeding. Adv Mater. 2018;30:1700859. DOI: 10.1002/adma.201700859
10. Eming SA, Krieg T, Davidson JM. Inflammation in wound repair: molecular and cellular mechanisms. J Invest Dermatol. 2007;127:514-25.
11. Midwood KS, Williams LV, Schwarzbauer JE. Tissue repair and the dynamics of the extracellular matrix. Int J Biochem Cell Biol. 2004;36:1031-7.
12. Caley MP, Martins VL, O’Toole EA. Metalloproteinases and wound healing. Adv Wound Care. 2015;4:225-34.
13. Rajendran NK, Kumar SSD, Houreld NN, Abrahamse H. A review on nanoparticle based treatment for wound healing. J Drug Deliv Sci Technol. 2018;44:421-30.
14. Tantiwatcharothai S, Prachayawarakorn J. Property improvement of antibacterial wound dressing from basil seed ( basilicum L.) mucilage-ZnO nanocomposite by borax crosslinking. Carbohydr Polym. 2020;227:115360. DOI: 10.1016/j.carbpol.2019.115360
15. Plichta JK, Radek KA. Sugar-coating wound repair: a review of FGF-10 and dermatan sulfate in wound healing and their potential application in burn wounds. J Burn Care Res. 2012;33:299-310.
16. Elsayed RE, Madkour TM, Azzam RA. Tailored-design of electrospun nanofiber cellulose acetate/poly (lactic acid) dressing mats loaded with a newly synthesized sulfonamide analog exhibiting superior wound healing. Int J Biol Macromol. 2020;164:1984-99.
17. Jayakumar R, Prabaharan M, Kumar PS, Nair S, Tamura H. Biomaterials based on chitin and chitosan in wound dressing applications. Biotechnol Adv. 2011;29:322-37.
18. Han G, Ceilley R. Chronic Wound Healing: A Review of Current Management and Treatments. Adv Ther. 2017;34:599-610.
19. Velnar T, Bailey T, Smrkolj V. The wound healing process: an overview of the cellular and molecular mechanisms. J Int Med Res. 2009;37:1528-42.
20. Liu X, Lin T, Fang J, Yao G, Zhao H, Dodson M, et al. In vivo wound healing and antibacterial performances of electrospun nanofibre membranes. J Biomed Mater Res A. 2010;94:499-508.
21. Huang Z-M, Zhang Y-Z, Kotaki M, Ramakrishna S. A review on polymer nanofibers by electrospinning and their applications in nanocomposites. Compos Sci Technol. 2003;63:2223-53.
22. Rezvani Ghomi E, Khalili S, Nouri Khorasani S, Esmaeely Neisiany R, Ramakrishna S. Wound dressings: Current advances and future directions. J Appl Polym Sci. 2019;136:47738. DOI: 10.1002/app.47738
23. Vasita R, Katti DS. Nanofibers and their applications in tissue engineering. Int J Nanomedicine. 2006; 1(1): 15–30.
24. Li D, Xia Y. Electrospinning of nanofibers: reinventing the wheel? Adv Mater. 2004;16:1151-70.
25. Liu M, Duan X-P, Li Y-M, Yang D-P, Long Y-Z. Electrospun nanofibers for wound healing. Mater Sci Eng C. 2017;76:1413-23.
26. Chen S, Liu B, Carlson MA, Gombart AF, Reilly DA, Xie J. Recent advances in electrospun nanofibers for wound Nanomedicine. 2017;12:1335-52.
27. Ding B, Yu J. Electrospun nanofibers for energy and environmental applications: Springer; 2014.
28. Teo WE, Ramakrishna S. A review on electrospinning design and nanofibre assemblies. Nanotechnology. 2006;17:89-106
29. Boakye MA, Rijal NP, Adhikari U, Bhattarai N. Fabrication and characterization of electrospun PCL-MgO-keratin-based composite nanofibers for biomedical applications. Materials. 2015;8:4080-95.
30. Mogoşanu GD, Grumezescu AM. Natural and synthetic polymers for wounds and burns dressing. Int J Pharm. 2014;463:127-36.
31. Sugimoto M, Morimoto M, Sashiwa H, Saimoto H, Shigemasa Y. Preparation and characterization of water-soluble chitin and chitosan derivatives. Carbohydr Polym. 1998;36:49-59.
32. Hudson SM, Jenkins DW. Chitin and chitosan. Encyclopedia of polymer science and technology. 2002;1. DOI:10.1002/0471440264.pst052.
33. Thakur VK, Thakur MK. Recent advances in graft copolymerization and applications of chitosan: a review. ACS Sustain Chem Eng. 2014;2:2637-52.
34. Jayakumar R, Prabaharan M, Sudheesh Kumar PT, Nair SV, Tamura H. Biomaterials based on chitin and chitosan in wound dressing applications. Biotechnol Adv. 2011;29:322-37.
35. Pakravan M, Heuzey M-C, Ajji A. A fundamental study of chitosan/PEO electrospinning. Polymer. 2011;52:4813-24.
36. Li L, Hsieh Y-L. Chitosan bicomponent nanofibers and nanoporous fibers. Carbohydr Res. 2006;341:374-81.
37. El‐Tahlawy K, Hudson SM. Chitosan: Aspects of fiber spinnability. J Appl Polym Sci. 2006;100:1162-8.
38. Vondran JL, Sun W, Schauer CL. Crosslinked, electrospun chitosan–poly (ethylene oxide) nanofiber mats. J Appl Polym Sci. 2008;109:968-75.
39. Zhao X-G, Shi J-L, Hu B, Zhang L-X, Hua Z-L. In situ formation of silver nanoparticles inside pore channels of ordered mesoporous silica. Mater Lett. 2004;58:2152-6.
40. Ansari SA, Khan MM, Ansari MO, Lee J, Cho MH. Biogenic synthesis, photocatalytic, and photoelectrochemical performance of Ag–ZnO nanocomposite. J Phys Chem C. 2013;117:27023-30.
41. Ahmed R, Tariq M, Ali I, Asghar R, Khanam PN, Augustine R, et al. Novel electrospun chitosan/polyvinyl alcohol/zinc oxide nanofibrous mats with antibacterial and antioxidant properties for diabetic wound healing. Int J Biol Macromol. 2018;120:385-93.
42. Yildirimer L, Thanh NT, Loizidou M, Seifalian AM. Toxicology and clinical potential of Nano today. 2011;6:585-607.
43. Sondi I, Salopek-Sondi B. Silver nanoparticles as antimicrobial agent: a case study on E. coli as a model for Gram-negative bacteria. J Colloid Interface Sci. 2004;275:177-82.
44. Pati R, Mehta RK, Mohanty S, Padhi A, Sengupta M, Vaseeharan B, et al. Topical application of zinc oxide nanoparticles reduces bacterial skin infection in mice and exhibits antibacterial activity by inducing oxidative stress response and cell membrane disintegration in macrophages. Nanomedicine. 2014;10:1195-208.
45. Sirelkhatim A, Mahmud S, Seeni A, Kaus NHM, Ann LC, Bakhori SKM, et al. Review on zinc oxide nanoparticles: antibacterial activity and toxicity mechanism. Nanomicro Lett. 2015;7:219-42.
46. Shenhar R, Norsten TB, Rotello VM. Polymer‐mediated nanoparticle assembly: structural control and applications. Adv Mater. 2005;17:657-69.
47. Balzani V, Credi A, Venturi M. The Bottom‐Up Approach to Molecular‐Level Devices and Machines. Chem Eur J. 2002;8:5524-32.
48. Khan A, Rashid A, Younas R, Chong R. A chemical reduction approach to the synthesis of copper nanoparticles. Int Nano Lett. 2016;6:21-6.
49. Dang TMD, Le TTT, Fribourg-Blanc E, Dang MC. Synthesis and optical properties of copper nanoparticles prepared by a chemical reduction method. ANSN. 2011;2:015009. DOI: 10.1088/2043-6262/2/1/015009
50. Sánchez-López E, Gomes D, Esteruelas G, Bonilla L, Lopez-Machado AL, Galindo R, et al. Metal-based nanoparticles as antimicrobial agents: an overview. Nanomaterials. 2020;10:292. DOI: 10.3390/nano10020292
51. Jatoi AW, Ogasawara H, Kim IS, Ni Q-Q. Polyvinyl alcohol nanofiber based three phase wound dressings for sustained wound healing applications. Mater Lett. 2019;241:168-71.
52. Sekar AD, Kumar V, Muthukumar H, Gopinath P, Matheswaran M. Electrospinning of Fe-doped ZnO nanoparticles incorporated polyvinyl alcohol nanofibers for its antibacterial treatment and cytotoxic studies. Eur Polym J. 2019;118:27-35.
53. An J, Zhang H, Zhang J, Zhao Y, Yuan X. Preparation and antibacterial activity of electrospun chitosan/poly (ethylene oxide) membranes containing silver nanoparticles. Colloid Polym Sci. 2009;287:1425-34.
54. Yuan J, Geng J, Xing Z, Shen J, Kang IK, Byun H. Electrospinning of antibacterial poly (vinylidene fluoride) nanofibers containing silver nanoparticles. J Appl Polym Sci. 2010;116:668-72.
55. Tijing LD, Ruelo MTG, Amarjargal A, Pant HR, Park C-H, Kim CS. One-step fabrication of antibacterial (silver nanoparticles/poly (ethylene oxide))–Polyurethane bicomponent hybrid nanofibrous mat by dual-spinneret electrospinning. Mater Chem Phys. 2012;134:557-61.
56. Montazer M, Malekzadeh S. Electrospun antibacterial nylon nanofibers through in situ synthesis of nanosilver: preparation and characteristics. J Polym Res. 2012;19:1-6.
57. Lee SJ, Heo DN, Moon J-H, Ko W-K, Lee JB, Bae MS, et al. Electrospun chitosan nanofibers with controlled levels of silver nanoparticles. Preparation, characterization and antibacterial activity. Carbohydr Polym. 2014;111:530-7.
58. Wang X, Cheng F, Gao J, Wang L. Antibacterial wound dressing from chitosan/polyethylene oxide nanofibers mats embedded with silver nanoparticles. J Biomater Appl. 2015;29:1086-95.
59. Rodríguez-Tobías H, Morales G, Ledezma A, Romero J, Grande D. Novel antibacterial electrospun mats based on poly (d, l-lactide) nanofibers and zinc oxide nanoparticles. J Mater Sci. 2014;49:8373-85.
60. Augustine R, Malik HN, Singhal DK, Mukherjee A, Malakar D, Kalarikkal N, et al. Electrospun polycaprolactone/ZnO nanocomposite membranes as biomaterials with antibacterial and cell adhesion properties. J Polym Res. 2014;21:1-17.
61. Annur D, Wang Z-K, Liao J-D, Kuo C. Plasma-synthesized silver nanoparticles on electrospun chitosan nanofiber surfaces for antibacterial applications. Biomacromolecules. 2015;16:3248-55.
62. Zhang Z, Wu Y, Wang Z, Zou X, Zhao Y, Sun L. Fabrication of silver nanoparticles embedded into polyvinyl alcohol (Ag/PVA) composite nanofibrous films through electrospinning for antibacterial and surface-enhanced Raman scattering (SERS) activities. Mater Sci Eng C. 2016;69:462-9.
63. Aktürk A, Taygun ME, Güler FK, Goller G, Küçükbayrak S. Fabrication of antibacterial polyvinylalcohol nanocomposite mats with soluble starch coated silver nanoparticles. Colloids Surf A Physicochem Eng Asp. 2019;562:255-62.
64. Kohsari I, Shariatinia Z, Pourmortazavi SM. Antibacterial electrospun chitosan-polyethylene oxide nanocomposite mats containing ZIF-8 Int J Biol Macromol. 2016;91:778-88.
65. Yang X, Yang J, Wang L, Ran B, Jia Y, Zhang L, et al. Pharmaceutical intermediate-modified gold nanoparticles: against multidrug-resistant bacteria and wound-healing application via an electrospun scaffold. ACS nano. 2017;11:5737-45.
66. Prado-Prone G, Silva-Bermudez P, Almaguer-Flores A, García-Macedo JA, García VI, Rodil SE, et al. Enhanced antibacterial nanocomposite mats by coaxial electrospinning of polycaprolactone fibers loaded with Zn-based nanoparticles. Nanomed: Nanotechnol Biol Med. 2018;14:1695-706.
67. Kharaghani D, Khan MQ, Tamada Y, Ogasawara H, Inoue Y, Saito Y, et al. Fabrication of electrospun antibacterial PVA/Cs nanofibers loaded with CuNPs and AgNPs by an in-situ method. Polym Test. 2018;72:315-21.
68. Patel S, Konar M, Sahoo H, Hota G. Surface functionalization of electrospun PAN nanofibers with ZnO–Ag heterostructure nanoparticles: synthesis and antibacterial study. 2019;30:205704.
69. Majumder S, Matin MA, Sharif A, Arafat MT. Electrospinning of antibacterial cellulose acetate/polyethylene glycol fiber with in situ reduced silver particles. J Polym Res. 2020;27:1-13.
70. Bagheri M, Validi M, Gholipour A, Makvandi P, Sharifi E. Chitosan nanofiber biocomposites for potential wound healing applications: Antioxidant activity with synergic antibacterial effect. Bioeng Transl Med. 2021:e10254. DOI: 10.1002/btm2.10254
71. Cui Y, Zhao Y, Tian Y, Zhang W, Lü X, Jiang X. The molecular mechanism of action of bactericidal gold nanoparticles on Escherichia coli. Biomaterials. 2012;33:2327-33.
72. Mukherjee A, Sadiq IM, Prathna T, Chandrasekaran N. Antimicrobial activity of aluminium oxide nanoparticles for potential clinical applications. Science against microbial pathogens: communicating current research and technological advances. 2011;1:245-51.
73. Balakrishnan SB, Kuppu S, Thambusamy S. Biologically important alumina nanoparticles modified polyvinylpyrrolidone scaffolds in vitro characterizations and it is in vivo wound healing efficacy. J Mol Struct. 2021;1246:131195.
74. Cai N, Li C, Han C, Luo X, Shen L, Xue Y, et al. Tailoring mechanical and antibacterial properties of chitosan/gelatin nanofiber membranes with Fe3O4 nanoparticles for potential wound dressing application. Appl Surf Sci. 2016;369:492-500.
75. Yildiz A, Bayramol DV, Atav R, Ağirgan AÖ, Kurc MA, Ergünay U, et al. Synthesis and characterization of Fe3O4@ Cs@ Ag nanocomposite and its use in the production of magnetic and antibacterial nanofibrous membranes. Appl Surf Sci. 2020;521:146332. DOI: 10.1016/j.apsusc.2020.146332
76. Wahab JA, Al Mamun S. Polyacrylonitrile nanofiber mats containing titania/AgNP composite nanoparticles for antibacterial applications. Mater Res Express. 2020;7:015416. DOI: 10.1088/2053-1591/ab6c26
77. Feng S, Zhang F, Ahmed S, Liu Y. Physico-mechanical and antibacterial properties of PLA/TiO2 composite materials synthesized via electrospinning and solution casting processes. Coatings. 2019;9:525. DOI: 10.3390/coatings9080525