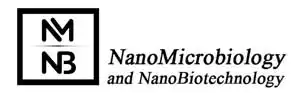NanoMicrobiol NanoBiotechnol, 2023 (1), 202311
DOI:
Review
Bacterial biological systems carrying nanoparticles: a smart solution for gene therapy
Ahmad Gholami 1, 2*
1 Biotechnology Research Center, Shiraz University of Medical Sciences
2 Pharmaceutical Science Research Center, Shiraz University of Medical Sciences
* Correspondence: gholami@sums.ac.ir
Abstract
Gene therapy is one of the most advanced strategies in molecular medicine for the treatment of diseases that so far medical science and pharmacy have not been able to find an effective and appropriate treatment for them. In the process of gene therapy, delivering genetic fragments to the target tissues and cells is one of the most fundamental steps to achieve success. Therefore, in the past years, various technologies have been developed for gene delivery. Gene delivery by using nanoparticles is one of these new technologies that has been able to provide significant successes. But it becomes more appealing when biotechnology and microbiology come to the aid of this process. In recent years, it has been tried to use bacterial cells as living robots to transfer nanoparticles carrying genetic fragments to target tissues and cells. These live micro-robots are now one of the main options in the development of gene delivery and gene therapy.
Keywords: Bacteria; Bactofection; Gene delivery; Gene therapy; Nanoparticles; Plasmid
ژن درمانی یکی از راهکارهای رو به پیشرفت در پزشکی مولکولی در جهت درمان بیماری هایی است که تا کنون علم پزشکی و داروسازی نتوانسه اند برای آنها درمان موثر و مناسبی را بیابند. در فرایند ژن درمانی رساندن قطعه ژنتیکی به بافت و سلول های هدف یکی از اساسی ترین مراحل جهت دست یابی به موفقیت است. لذا در سال های گذشته فناوری های گسترده و متنوعی در جهت ژن رسانی توسعه یافته اند. ژن رسانی با استفاده از نانوذرات یکی از این فناوری های جدید است که در سایه توسعه فناوری های زیست پزشکی توانسته موفقیت های چشم گیری را فراهم اورد. اما موضوع زمانی جذابتر می شود که فناوری های زیستی و علم میکروب شناسی به کمک این فرایند بیایند. در سال های اخیر تلاش شده تا از سلول های باکتری به عنوان ربات های زنده جهت انتقال نانوذرات حامل قطعات ژنتیکی به بافت ها و سلول های هدف استفاده شود. این میکروروبوت های زنده هم اکنون یکی از گزینه های اصلی در توسعه ژن رسانی و ژن درمانی می باشند.
در سالهای اولیهی هزارهی سوم، آزادسازی DNA پلاسمیدی به درون سلولهای پستانداران با استفاده از باکتریهایی که پاتوژنوسیتی آنها کاهش یافته بود به عنوان یک راه حل جایگزین جهت واکسیناسیون ژنتیکی و ژن درمانی مطرح گردید. در حقیقت با الهام از ایدهی واکسیناسیون پیشنهاد شد که انواع خاصی از باکتریهای تضعیف شده مسئولیت انتقال اختصاصی DNA پلاسمیدی به هستهی سلولها را بر عهده گیرند. این ایده بعدها با موفقیت انجام گردید و تحت اصطلاح «باکتوفسیون» عمومیت پیدا کرد. امروزه واژهی باکتوفکسیون جهت توصیف انتقال اسیدهای نوکلئیک به درون سلولهای پستانداران به واسطهی باکتری به کار گرفته میشود (1). باکتوفکسیون این پتانسیل را دارد که به عنوان راهکاری مطمئن برای انتقال ژن و بیان پروتئینهای هترولوگ در انواع مختلف سلولهای پستانداران مورد استفاده قرار گیرد. امروزه این باکتری ها یکی از حاملهای مهم غیرویروسی جهت انتقال DNA و ژن درمانی هستند. در روند ژن درمانی بر مبنای باکتوفکسیون، باکتری نقش حاملی را ایفا میکند که پلاسمید حاوی ژن دلخواه را به سلول میزبان یوکاریوتی انتقال میدهد. این روش قابلیتهای فراوانی از خود نشان داده است و بیان پلاسمید کدکنندهی انواع پروتئین های هترولوگ (آنتیژن ها، هورمونها، توکسینها و آنزیمها) در رده های مختلف سلولی فاگوسیت کننده یا غیرفاگوسیت کنندهی پستانداران توسط آنها امکان پذیر شده است (2).
فرایند ژن رسانی باکتوفکسیون با ورود باکتری به درون سلولهای هدف آغاز میگردد (3, 4). با لیز شدن اتفاقی – یا القایی – باکتری، پلاسمید درون فضای سیتوپلاسم سلول یوکاریوتی آزاد شده و میتواند بیان گردد (5, 6). مطالعات متعددی که به تازگی انجام گرفته نشان میدهد که باکتوفکسیون عملاً چه بهصورت برون تن و چه به صورت درون تن قابلیت انتقال ژن را با استفاده از باکتریهای متعددی از جمله Shigella flexneri (7)، Salmonella typhi (8)، Listeria monocytogenes (9)، Pseudomonas aeruginosa (10) و سویهی نوترکیب تهاجمی Escherichia coli (4, 11, 12) داراست. این باکتریها برای انجام فرآیند ژن رسانی نیاز به مولکولهایی در سطح سلول میزبان دارند تا بهصورت اختصاصی به آن متصل شوند و همچنین زمانی که وارد سلول شدند برای اثربخشی بهتر میبایست توسط عوامل خارجی تخریب شوند تا DNA خود را آزاد کنند. سیستمهای باکتوفکسیونی مبتنی بر L. monocytogenes از این طریق توانستهاند بهطور موثری مواد ژنتیکی خود را به درون هستهی سلول انتقال دهند (13).
سیستم های بیولوژیک پروکاریوتی به عنوان حاملهای انتقال ژن مزایای بالقوهی فراوانی دارند (14). یکی از این مزایا سادگی کاربرد آنها و انتقال نسبتا انتخابی ژن توسط آنها است. در اینجا تکثیر باکتری حامل مواد ژنتیکی و همچنین تکثیر خود مادهی ژنتیکی نسبت به سایر روشهای ژن درمانی با سرعت بیشتر و قیمت بسیار پایینتر قابل انجام است. علاوه بر این، مزیت منحصر به فرد باکتوفکسیون حساسیت آن به آنتی بیوتیکهای موجود است که ما را قادر به کنترل ژن ها پس از تجویز مینماید (15). ضمن اینکه باکتریها خودشان میتوانند درون سلولهای توموری تکثیر شوند و حتی موجب مهار رشد تومور شوند که این امر در ژن درمانی سرطان بسیار حائز اهمیت است (16, 17). این ویژگیهای منحصر به فرد باکتری ها موجب شده که طی سالهای اخیر همواره به عنوان یک حامل انتقال ژن ایده آل مطرح باشند (18).
پیشرفتهای بشر در زمینهی باکتوفکسیون کماکان روند افزایشی را دنبال میکند اما رویکردی که از ترکیب میکروب شناسی با نانوتکنولوژی به دست میآید میتواند یک گام بزرگ روبه جلو در زمینهی ژن درمانی ایجاد نماید (19). یکی از دغدغه های اصلی باکتوفکسیون انتقال DNA از داخل باکتری به درون سلول میزبان است. معمولا این روند مستلزم آن است که باکتری ابتدا لیز شده و سپس پلاسمید آزاد گردد (20). از سوی دیگر، نانوذرات پوشش داده شده با DNA پلاسمیدی میتوانند محموله ژنتیکی خود را بسیار موثرتر انتقال دهند و سیستم کارآمدتری را برای انتقال آنها به هستهی سلول میزبان فراهم میکنند. ترکیب نانوذرات و باکتریها می تواند ابزار بسیار مناسبی جهت انتقال ژن و پروتئین به درون سلول های پستانداران به منظور پایش یا تغییر بیان ژن و تولید پروتئین فراهم آورد. محققین نشان دادهاند ترکیب نانوذرات و باکتریها میتواند جهت عرضهی مولکولهای دارویی مدل DNA به سلولهای یوکاریوتی بهصورت درون تن و برون تن، سیستم هوشمند قابل تأملی را بهوجود آورد. باکتریها میتوانند توسط نانوذرات پوشش داده شوند تا این مجموعه پس از اتصال به سطح باکتری به درون بافتها و سلولها انتقال پیدا کند. در واقع در این مدل ژن رسانی، ژنها ابتدا بر سطح نانوذرات بارگذاری میشوند و سپس باکتری انتقال دهندهی محمولهی نانوذرهای که در اصطلاح «میکروبوت» خوانده میشود توسط سلول یوکاریوتی برداشت شده و نهایتاً ژنهای آزاد شده از نانوذرات در سلول میزبان بیان می شوند (21). از آنجایی که میکروبوتها بر سطح خود نانوذرات را حمل مینمایند، DNA پلاسمیدی متصل شده به نانوذرات نسبت به روشهای معمول باکتوفکسیون با سهولت و یکنواختی بسیار بهتری به بخشهای داخلی سلول دسترسی پیدا میکند (22). نتایج لومینسانس نشان داد موشهایی که میکروبوت به آنها تزریق شده توانستهاند بهصورت موفقیت آمیزی ژن مدل دارویی را در ارگان های مختلف خود بیان کنند (23). این راهکار میتواند بدون احتیاج به دستکاریهای پیچیدهی ژنتیکی جهت ارائهی انواع مختلف محمولههای مولکولی به حیوانات زنده و ردههای متنوع سلولی مورد استفاده قرار گیرد. سلولها عملکردها و شرایط خود را از طریق فرایندهای متعدد سیگنالینگ داخل سلولی کنترل میکنند. این فرایندها معمولاً تحت تأثیر مولکولهای لیگاندی قرار میگیرد که به گیرندههای سطح سلول متصل میشوند. بدون شک میزان و گستردگی اتصال بین گیرنده و لیگاند بر روی شدت و طول دورهی سیگنالینگ درون سلولی و سایر پیش آمدهای متعاقب آن تأثیر قابل توجهی دارد (24). لیگاندهایی که چندین محل اتصال به گیرنده دارند (که به نام لیگاندهای چند ظرفیتی مشهورند) میتوانند با اتصال متقاطع با چند گیرندهی سطح سلولی بهطور بسیار موثرتری فرایندهای سیگنالینگ درون سلولی را تنظیم نمایند (25). نانوذراتی که با آنتیبادی های مختلف پوشش داده شدهاند امکان این را پیدا میکنند که همانند لیگاندهای چندظرفیتی عمل نمایند؛ بهطوری که توانایی اتصال متقاطع با گیرندههای اختصاصی سطح سلولی را پیدا کنند. با ایجاد تغییر در اندازهی ذرهای، شکل و نوع نانوذرهی مهندسی شده میتوان میزان اتصال متقاطع و پاسخ سلولی متعاقب آن را با دقت زیاد کنترل نمود. مشاهدات اخیر در سیستمهای بیولوژیک نشان داده است که ویژگیهای فیزیکوشیمیایی نانوذرات بر روی برداشت غیراختصاصی آنها توسط سلول تأثیرگذار است و بنابراین بهطور بالقوه بر نحوهی القای پاسخهای سلولی نیز موثر است (26). این مطالعات نشان میدهد ترکیب نانوذرات و سیستمهای بیولوژیک باکتریایی تا چه اندازه پتانسیل یکدیگر را افزایش میدهند. در حال حاضر زیست شناسان و دانشمندان دانشگاه پوردو با امتزاج هوشمندانهی میکروبیولوژی و نانوتکنولوژی، از باکتریها برای عرضهی نانوذرات پوشش داده شده با ژن استفاده نمودهاند. برای اینکه سیستم طراحی شده بتواند نقش تأثیرگذاری در ژن درمانی پیدا کند میبایست ابتدا اثربخشی باکتری ها به عنوان سیستم عرضه کنندهی نانوذره افزایش پیدا کند و به این توانایی دست یابد که نانوذره را به صورت اختصاصی به سلولهای ویژهی انسانی برساند (19).
میکروبوت ها با راهکار هوشمندانهای که اتخاذ نمودهاند مسیر جدیدی را برای محققین حوزهی نانو باز کردهاند که بیان میکند امکان رساندن مولکولهای دیگری غیر از DNA نیز از این طریق امکانپذیر است. به عنوان مثال میکروبوتها ممکن است جهت عرضهی هدفمند ملکولهایی نظیر هورمونها، آنزیمها، توکسینها و مولکول های SiRNA بهمنظور اهداف درمانی مورد استفاده قرار گیرند (27). بهعلاوه، از آنجایی که ثابت شده است باکتوفکسیون در درمان ملانوما و کارسینومای کولون و ریه موثر است (28)، این یافته ها میتواند برهان خوبی در جهت رویکردهای جدید در درمان تومورها باشد.
یکی از خواص جذاب سیستمهای بیولوژیک حامل نانوذرات عرضهی هدفمند و اختصاصی به سلولهاست که این امر موجب میشود دوز نانوذراتی که نیاز است جهت اهداف درمانی تجویز شوند به نحو چشمگیری کاهش پیدا کند. به وضوح میتوان اثبات کرد که ترکیب سیستم باکتریایی حامل نانوذره به همراه بیان پروتئین نوترکیب در باکتری روش بسیار کارآمدی برای تخریب هدفمند سلولهای سرطانی است. به طور خاص این واقعیت که بیان ژن درون باکتری علی الخصوص زمانی که وارد سلول میزبان میشود قابل بهینه سازی است راهکاری بسیار جذاب را برای دانشمندان به ارمغان می آورد: وقتی که این سیستم وارد سلول سرطانی هدف شد نانوذرات حامل یک پیش داروی نسبتاً غیرسمی نیز به سلول عرضه میشود. حال میتوان باکتری حامل را به گونه ای انتخاب نمود تا پروتئینی را بیان کند که پیش دارو را به فرم قوی تر و سمی تر در میآورد. این راهکار بسیار جذاب می تواند به صورت کاملا اختصاصی سلول های توموری را از بین ببرد؛ بدون اینکه عوارض روشهای متداول شیمی درمانی را به دنبال داشته باشد (19).
نتیجه گیری
بههرحال باید اذعان کرد که افزایش اثربخشی این رویکرد نوین در ژن درمانی به کمک فناوری نانو و علم میکروب شناسی هنوز در گامهای اولیهی خود قرار دارد. بهمنظور افزایش کارآیی ژن رسانی با استفاده از ترکیب باکتری و نانوذرات میبایست از سایر مطالعات بیولوژیک و بالینی که با استفاده از باکتریها و نانوذرات انجام شده اطلاعات کاملتری حاصل نمود.
فهرست منابع:
- Baban CK, Cronin M, O’Hanlon D, O’Sullivan GC, Tangney M. Bacteria as vectors for gene therapy of cancer. Bioengineered Bugs. 2010;1(6):385-94.
- Okafor F, Janen A, Kukhtareva T, Edwards V, Curley M. Green Synthesis of Silver Nanoparticles, Their Characterization, Application and Antibacterial Activity. Int J Env Res Public Health. 2013;10(10):5221-38.
- Lopez-Ruiz A, Verbelen JP, Roldan JM, Diez J. Nitrate reductase of green algae is located in the pyrenoid. Plant Physiol. 1985;79(4):1006-10.
- Sultana A, Kumar R. Modified bactofection for efficient and functional DNA delivery using invasive E. coli DH10B vector into human epithelial cell line. J Drug Deliv Sci Technol. 2022;70:103159.
- Rice KC, Bayles KW. Death’s toolbox: examining the molecular components of bacterial programmed cell death. Molecular microbiology. 2003;50(3):729-38.
- Sultana A, Tiash S. Improved DNA delivery using invasive E. coli DH10B in human cells by modified bactofection method. J Controlled Release. 2021;332:233-44.
- Mahdieh M, Zolanvari A, Azimee AS, Mahdieh M. Green biosynthesis of silver nanoparticles by Spirulina platensis. Sci Iranica. 2012;19(3):926-9.
- Mandal D, Bolander ME, Mukhopadhyay D, Sarkar G, Mukherjee P. The use of microorganisms for the formation of metal nanoparticles and their application. Appl Microbiol Biotechnol. 2006;69(5):485-92.
- Mohanpuria P, Rana NK, Yadav SK. Biosynthesis of nanoparticles: technological concepts and future applications. J Nanopart Res. 2008;10(3):507-17.
- Mukherjee P, Roy M, Mandal B, Dey G, Mukherjee P, Ghatak J, et al. Green synthesis of highly stabilized nanocrystalline silver particles by a non-pathogenic and agriculturally important fungus T. asperellum. Nanotechnol. 2008;19(7):075103.
- Parikh RY, Singh S, Prasad B, Patole MS, Sastry M, Shouche YS. Extracellular synthesis of crystalline silver nanoparticles and molecular evidence of silver resistance from Morganella sp.: towards understanding biochemical synthesis mechanism. ChemBioChem. 2008;9(9):1415-22.
- Park D, Hill A, Pfeifer BA. Improving E. coli Bactofection by Expression of Bacteriophage ΦX174 Gene E. Bio-Carrier Vectors: Springer; 2021. p. 3-14.
- Ansari M, Khan H, Khan A, Malik A, Sultan A, Shahid M, et al. Evaluation of antibacterial activity of silver nanoparticles against MSSA and MRSA on isolates from skin infections. Biol Med. 2011;3(2):141-6.
- Belete TM. The current status of gene therapy for the treatment of cancer. Biologics: targets & therapy. 2021;15: 67–77.
- Sathishkumar M, Sneha K, Yun Y-S. Immobilization of silver nanoparticles synthesized using Curcuma longa tuber powder and extract on cotton cloth for bactericidal activity. Bioresour Technol. 2010;101(20):7958-65.
- Alt V, Bechert T, Steinrücke P, Wagener M, Seidel P, Dingeldein E, et al. An in vitro assessment of the antibacterial properties and cytotoxicity of nanoparticulate silver bone cement. Biomaterials. 2004;25(18):4383-91.
- Lin D, Feng X, Mai B, Li X, Wang F, Liu J, et al. Bacterial-based cancer therapy: An emerging toolbox for targeted drug/gene delivery. Biomaterials. 2021;277:121124.
- Barwal I, Ranjan P, Kateriya S, Yadav SC. Cellular oxido-reductive proteins of Chlamydomonas reinhardtii control the biosynthesis of silver nanoparticles. J Nanobiotechnol. 2011;9(1):1-12.
- Dietrich G. Bioengineering: Bacteria give nanoparticles a ride. nature nanotechnology. 2007;2(7):394-5.
- Ingle A, Rai M, Gade A, Bawaskar M. Fusarium solani: a novel biological agent for the extracellular synthesis of silver nanoparticles. J Nanopart Res. 2009;11(8):2079-85.
- Jain D, Kachhwaha S, Jain R, Srivastava G, Kothari S. Novel microbial route to synthesize silver nanoparticles using spore crystal mixture of Bacillus thuringiensis. Indian J Exp Biol. 2010;48(11):1152-6.
- Lee H, Yeo S, Jeong S. Antibacterial effect of nanosized silver colloidal solution on textile fabrics. J Mater Sci. 2003;38(10):2199-204.
- Akin D, Sturgis J, Ragheb K, Sherman D, Burkholder K, Robinson JP, et al. Bacteria-mediated delivery of nanoparticles and cargo into cells. Nat Nanotechnol. 2007;2(7):441-9.
- Bhainsa KC, D’Souza S. Extracellular biosynthesis of silver nanoparticles using the fungus Aspergillus fumigatus. Colloids Surf B. 2006;47(2):160-4.
- Faghri Zonooz N, Salouti M. Extracellular biosynthesis of silver nanoparticles using cell filtrate of Streptomyces sp. ERI-3. Sci Iranica. 2011;18(6):1631-5.
- Gadd GM. Metals, minerals and microbes: geomicrobiology and bioremediation. Microbiol. 2010;156(3):609-43.
- Kalimuthu K, Suresh Babu R, Venkataraman D, Bilal M, Gurunathan S. Biosynthesis of silver nanocrystals by Bacillus licheniformis. Colloids Surf B. 2008;65(1):150-3.
- Lara HH, Ayala-Núnez NV, Turrent LdCI, Padilla CR. Bactericidal effect of silver nanoparticles against multidrug-resistant bacteria. World J Microbiol Biotechnol. 2010;26(4):615-21.