NanoMicrobiol NanoBiotechnol, 2022 (1), 202213
DOI: 10.52547/nanomicrob.2022.1.3
Review
Lipid nanoparticles and mRNA vaccines
Sedigheh Nakhaee1
1 Department of Bacteriology & Virology, School of Medicine, Shiraz University of Medical Sciences, Shiraz, Iran
* Correspondence: s_nakhaei@sums.ac.ir
Abstract
A novel generation of vaccines based on the mRNA technology was developed, approved, and administered during the Covid-19 pandemic. Beside delivery problems that biomedical scientists are faced with, the other major problem with the mRNA molecules is their low stability. A vaccine or any other drug which is based on the mRNA technology needs to overcome both of mentioned problems.
Lipid nanoparticles were found to be a promising carrier that can protect the mRNA from degradation in the body and also deliver the structure to the target tissue and cells. There are four main part that make lipid nanoparticles, phospholipids, cholesterol, ionizable lipids, and polyethylene glycol (PEG). Lipid nanoparticles can take mRNA molecules to the cytoplasm of target cells, the site that translation of mRNA can take place.
Resulted protein can be introduced to the immune system to trigger immune response and provides immunity. The mRNA portion can be replaced with anew mRNA to fabricate mRNA vaccine against new strains and also other diseases. So, mRNA technology can be considered as a new vaccine generation that makes future vaccines.
Keywords: Covid-19; Drug delivery; Lipid nanoparticles; mRNA therapy; mRNA vaccine; Pandemic; Corona virus
1 مقدمه
بیماری کرونا (COVID-19) یک بیماری عفونی است که توسط ویروس SARS-CoV-2 ایجاد میشود. مانند دیگر عفونتهای میکروبی، عفونت با این ویروس الزاما به همراه بروز علائم بالینی و بیماری نیست. اکثر افرادی که علائم بالینی در آنها بروز میکند و به بیماری مبتلا میشوند علائم خفیف تا متوسط را تجربه میکنند در نهایت بدون درمان خاصی بهبود مییابند. با این حال، برخی به شدت بیمار میشوند و نیاز به مراقبت پزشکی دارند. احتمال ابتلا به بیماری شدید در بیماران مسن و افرادی که شرایط پزشکی زمینه ای خاصی دارند بیشتر است (1, 2).
ویروس جدید کرونا اولین بار در شهر ووهان چین در دسامبر 2019 شناسایی شد. قرنطینه در ووهان و سایر شهرهای اطراف نتوانست شیوع بیماری را مهار نماید و لذا ویروس جدید به سرعت به سایر نقاط سرزمین اصلی چین و در سراسر جهان گسترش یافت. سازمان بهداشت جهانی (WHO) در 30 ژانویه 2020 وضعیت اضطراری بهداشت عمومی را با نگرانی بین المللی اعلام کرد و در 11 مارس 2020 یک بیماری همه گیر اعلام شد. از آن زمان تاکنون سویههای مختلفی از این ویروس در بسیاری از کشورها ظهور کرده و گسترش یافتند. در این میان سویههای آلفا، بتا، گاما و دلتا خطرناکترین سویههای کروناویروس جدید بوده اند. آخرین سویه ای که از این ویروس گزارش گردیده سویه اومیکرون میباشد که در آفریقای جنوبی بروز نمود (3, 4).
با توجه به تلفات میلیونی رخ داده در پاندمی کرونا شاید باور کردنی نباشد که پاندمی کرونا بتواند جان میلیاردها نفر را نجات دهد. اما در طول تاریخ بشر، بحرانهای گسترده بهداشت عمومی منجر به نوآوری در مراقبتهای پزشکی و فناوری شده است. به عنوان مثال، جنگهای جهانی موجب توسعهی چشمگیر در صنایع هوا فضا شدند. همهگیری آنفولانزای 1918 منجر به فناوری مدرن واکسن شد. همه گیری کووید -19 نیز شرایط مشابهی را ایجاد کرده است. اگر به تاریخچه واکسنهایی که تاکنون توسط بشر ساخته شده نگاهی داشته باشیم در مییابیم که این واکسنها معمولاً طی سالیان متمادی توسعه یافته اند. اما واکسنهای mRNA که علیه کرونا ویروس جدید توسعه یافتند در زمان بسیار اندک و کمتر از یک سال تولید شده، مجوز دریافت کردند و مورد مصرف همگانی قرار گرفتند.
سالها است که تلاش میشود تا فناوری mRNA به مرحله ای از رشد برسد که بتوان از آن در شرایط اضطراری استفاده کرد. به طور خاص، بزرگترین مشکل با مولکول mRNA آن است که به طور معمول این مولکول را نمیتوان به مکان مورد نظر در بدن رسانید (5). تجویز یک مولکول mRNA یا به صورت وریدی و یا ماهیچه ای صورت میگیرد و درواقع نیاز است تا این مولکول خود را به داخل سلولهای هدف برساند تا بتواند موثر واقع شود. اما بزرگترین مشکل در این مسیر آن است که مولکولهای mRNA ناپایدار هستند و بلافاصله پس از تزریق در بدن تجزیه شده و از بین میروند. مشکل دیگر ایجاد مکانیسمی اختصاصی است تا بتوان mRNA را به محل هدف رسانید. بنابراین اگر بخواهیم از mRNA به عنوان یک عامل درمانی استفاده کنیم، این مولکول شکننده به حفاظت احتیاج دارد و به علاوه باید به نحوی طراحی گردد که برای بافت هدف در داخل بدن اختصاصی عمل نماید (6).
در سالهای اخیر نانوذرات لیپیدی به عنوان یک سیستم مناسب جهت بسته بندی مولکول mRNA و همچنین رساندن آن به بافت هدف مورد توجه ویژه قرار گرفته اند (7). نانوذرات لیپیدی از تجمع چندین مولکول لیپید تشکیل شده اند. لیپیدها مولکولهای انعطاف پذیر و بسیار مناسبی جهت فرمولاسیون مولکولهای دارویی هستند. سالها پیش دانشمندان ایدهی ایجاد نانوذرات لیپیدی را مطرح کردند تا بتوان از آنها مانند اسب تروجان استفاده نمود (8). از آنجا که چربیهای موجود در نانوذرات مشایه غشاهای سلولی هستند، سلولها مایل هستند تا این نانوذرات را به داخل خود وارد نمایند. این رویداد دقیقا همان فرایندی است که طی آن mRNA موجود در نانوذرات لیپیدی به داخل سلول منتقل میشود.
2 ساختار نانوذرات لیپیدی
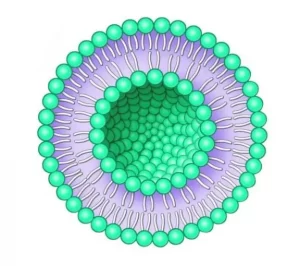
نانوذرات لیپیدی به طور معمول از چهار ماده متفاوت تشکیل شده اندکه درادامه به بررسی اجمالی آنها خواهیم پرداخت (9, 10). همان طور که از نام این نانوذرات مشخص است، مولکول اصلی تشکیل دهنده نانوذرات لیپیدی در واقع لیپیدی به نام فسفولیپید میباشد. این مولکول همان عنصر اصلی در غشای سلولی است. غشای سلول قسمت داخلی سلولها را از محیط اطراف جدا میکند. فسفولیپیدها دارای یک سر آب دوست و دم چربی دوست هستند. بنابراین وقتی این مولکولها درآب قرار گیرند، یک ساختار منظم ایجاد مینمایند که دو لایه چربی نامیده میشود (شکل 1). در این ساختار دولایه، سرهای آب دوست به سمت داخل و خارج ساختار قرار گرفته و قسمتهای چربی دوست مولکول در وسط ساختار و به سمت یکدیگر قرار میگیرند. در نانوذرات لیپیدی، فسفولیپیدها نقش مشابهی در سازماندهی سایر اجزا و شکل گیری نانوذرات دارند.
شکل 1. ساختار دولایه فسفولیپیدی که در نتیجه امتزاج فسفولیپیدها و آب ایجاد می شود
دومین جزء تشکیل دهنده نانوذرات لیپیدی، یک مولکول لیپیدی دیگر به نام کلسترول است. کلسترول در ساختار نانوذرات لیپیدی دقیقا مانند زمانی که در غشای سلولی قرار میگیرد عمل مینماید. بدین معنی که در ساختار نانوذرات لیپیدی نیز کلسترول در بین سایر لیپیدها قرار گرفته و شکافها را پر کرده و لیپیدها را در کنار هم نگه میدارد. با این کار کلسترول ساختار نانوذرات لیپیدی را پشتیبانی میکند تا نانوذرات در فاصله بین تزریق و رسیدن به محل اثر از هم پاشیده نشوند.
سومین جزء نانوذرات لیپیدی، لیپیدهای قابل یونیزاسیون هستند. در اینجا، ” قابل یونیزاسیون” بدین معنی است که وقتی این لیپیدها در جریان خون هستند، بار خنثی دارند، که به ایمنی آنها کمک میکند. اما در داخل سلولهای بدن بار الکتریکی آنها به یک بار مثبت تغییر مییابد که به آنها کمک می کند تا مولکول mRN موجود در نانوذره را آزاد کنند. لیپیدهای قابل یونیزاسیون مولکولهای سنتزی هستند و به روشهای شیمیایی ساخته میشوند. به دلیل این که این مولکولها در آزمایشگاه ساخته میشوند دارای انحصار برای شرکت ابداع کننده و سازنده هستند. به عنوان مثال شرکتهای Moderna و BioNTech، که با کمپانی Pfizer در ساخت واکسن کرونا همکاری کرده اند، لیپیدهای مختلف قابل یونیزاسیون را جهت فرمولاسیون مناسب واکسن در اختیار کمپانی Pfizer قرار داده اند. این لیپیدهای خاص تنها عنصر مهم در mRNA واکسنهای COVID-19 هستند که این واکسن را متفاوت ساخته اند.
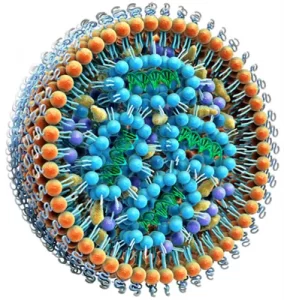
آخرین ترکیبی که در ساخت نانوذرات لیپیدی از آن استفاده میشود پلی اتیلن گلیکول (PEG) است. این ماده پلیمری یک مولکول آب دوست است و با احاطه کردن نانوذره لیپیدی همه اجزای آنرا در کنار هم نگه میدارد. شواهدی وجود دارد که PEG میتواند در ایجاد واکنشهای آلرژیک نقش داشته باشد. و این امر به آن دلیل است که مردم به طور معمول در محصولات آرایشی و خانگی در معرض PEG قرار میگیرند و آنتی بادی علیه PEG در بدن برخی از آنها تولید شده است. اما باید به خاطر داشته که PEG سابقه طولانی و ایمن در فرمولاسیونهای دارویی مورد تأیید FDA داشته است. حساسیت به واکسن میتواند ناشی از موارد دیگری غیر از PEG نیز باشد. برای درک کامل این عوارض، تحقیقات بیشتری لازم است. ساختار کلی نانوذرات لیپیدی در شکل 2 قابل مشاهده است.
3 مکانیسم عمل mRNA واکسنها
مولکول mRNA یک مولکول پیام رسان در داخل سلولهای زنده است که اطلاعات لازم جهت ساخت مولکولهای پروتئینی را فراهم مینماید. با استفاده از این مولکولهای پیام رسان دستگاه سنتز پروتئین سلولی انواع متنوعی از پروتئینها را میتواند سنتز نماید. در مورد واکسنهای فرموله شده با فناوری نانوذرات لیپیدی، پس از تزریق این نانوذرات به ماهیچهها، mRNA به داخل سلولها منتقل میشود. در آنجا، mRNA مانند یک دستورالعمل رفتار میکند که به سلولهای دستور ساخت یک پروتئین خارجی را میدهد. در مورد واکسن کرونا، پروتئین خارجی در واقع پروتئین شاخک (اسپایک) کروناویروس است. وقتی سلولهای ایمنی با پروتئین شاخک مواجه میشوند، علیه این پروتئین ایجاد ایمنی و خاطره میشود. در حال حاضر، واکسنهای mRNA جان افراد را از ویروس کرونا نجات میدهند. آنها اولین و بهترین ابزار برای مقابله با پاندمی بودند و بهترین امید سیستمهای بهداشت ودرمان جهت پاسخ سریع به واریتههای ویروسی جدید هستند. این امکان از آن جهت فراهم شده است که با استفاده از فناوری نانوذرات لیپیدی میتوان ساختار و اجزاء نانوذرات را یکسان نگهداشت و تنها با تعویض mRNA داخل آنها با یک مولکول mRNA جدید واکسن جدیدی را علیه سویههای جدید ویروسی ایجاد نمود (11, 12).
شکل 2. نمای شماتیک از ساختار کلی یک نانوذره لیپیدی که حامل مولکول های اسید نوکلئیک می باشد
4 دیگر کاربردهای درمانی mRNA
مانند آنچه که در مورد واکسن کرونا ویروس جدید انجام گرفت، این امکان وجود دارد که از فناوری mRNA جهت ساخت واکسنهایی علیه برخی از کشنده ترین و ترسناک ترین عوامل بیماری زا در سراسر جهان از جمله مالاریا، ابولا و ایدز استفاده شود. برخی از این محصولات در حال حاضر در آزمایشات بالینی هستند و موفقیت حاصل شده در مورد واکسن COVID-19 راه را برای دست یابی به دیگر واکسنها هموار میکند.
فناوری استفاده از mRNA نه تنها در ساخت واکسنها بلکه میتواند برای درمان بسیاری از بیماریها استفاده شود. در آینده درمان بسیاری از بیماریهای لاعلاج، از جمله فیبروز کیستیک، دیستروفی عضلانی و کم خونی داسی شکل با استفاده از فناوری درمانی mRNA در دسترس قرار خواهد گرفت. این بیماریها توسط پروتئینهای جهش یافته ایجاد میشوند و میتوان با استفاده از فناوری درمانی mRNA سلولها را در جهت ساخت نسخهی صحیح این پروتئینها هدایت نمود. امید میرود در آینده با استفاده از این فناوری درمان سرطانهای مختلف از جمله سرطان سینه، خون، ریه و دیگر سرطانها ممکن شود. در مورد درمان سرطان، با استفاده از فناوری mRNA میتوان سلولهای ایمنی بدن را جهت پاسخ به سلول های سرطانی تحریک نمود (13، 14).
نتیجه گیری
جهانگیری کرونا میتواند جان میلیون ها نفر را نجات دهد. این جهانگیری سریع ترین فرایند توسعه واکسن در تاریخ را رقم زد و نوعی از فناوری را که قبلاً تأیید نشده بود، زنده کرد. اکنون دانشمندان در حال جمع آوری دادههای ایمنی و اثربخشی طولانی مدت فناوری mRNA در صدها میلیون نفر هستند. با استفاده از این دادهها، میتوان نقاط ضعف و قدرت این فناوری را به خوبی دریافت. با نگاهی به آینده میتوان گفت که فرمولاسیون و تحویل mRNA به سلولهای اندامها و بافتهای هدف همچنان یکی از مهمترین چالشهای این فناوری خواهد بود. با این همه میتوان گفت که بشر در آستانهی یک انقلاب بزرگ است. فناوری mRNA در حال تغییر جهان برای همیشه است و این همه به لطف نانوذرات لیپیدی است که این داروی معجزه آسا را دقیقاً به محل مورد نظر حمل میکند.
منابع
-
- Khan S, Tombuloglu H, Hassanein SE, Rehman S, Bozkurt A, Cevik E, et al. Coronavirus diseases 2019: current biological situation and potential therapeutic perspective. Eur J Pharmacol. 2020;886:173447. DOI: 10.1016/j.ejphar.2020.173447
- Zhao M, Wang M, Zhang J, Ye J, Xu Y, Wang Z, et al. Advances in the relationship between coronavirus infection and cardiovascular diseases. Biomed Pharmacother. 2020;127:110230. DOI: 10.1016/j.biopha.2020.110230
- Mohammadi M, Shayestehpour M, Mirzaei H. The impact of spike mutated variants of SARS-CoV2 [Alpha, Beta, Gamma, Delta, and Lambda] on the efficacy of subunit recombinant vaccines. Braz J Infect Dis. 2021;25(04): DOI: 10.1016/j.bjid.2021.101606.
- Duong D. Alpha, Beta, Delta, Gamma: What’s important to know about SARS- CoV-2 variants of concern?. Can Med Assoc. 2021;193(27):E1059-E1060.
- Shin H, Park SJ, Yim Y, Kim J, Choi C, Won C, et al. Recent advances in RNA therapeutics and RNA delivery systems based on nanoparticles. Adv Ther. 2018;1(7):1800065. DOI: 10.1002/adtp.201800065
- Guan S, Rosenecker J. Nanotechnologies in delivery of mRNA therapeutics using nonviral vector-based delivery systems. Gene Ther. 2017;24(3):133-43.
- Hou X, Zaks T, Langer R, Dong Y. Lipid nanoparticles for mRNA delivery. Nat Rev Mater. 2021;6: 1078–94.
- Pardeike J, Hommoss A, Müller RH. Lipid nanoparticles (SLN, NLC) in cosmetic and pharmaceutical dermal products. Int J Pharm. 2009;366(1-2):170-84.
- Lingayat VJ, Zarekar NS, Shendge RS. Solid lipid nanoparticles: a review. Nanosci Nanotechnol Res. 2017;2:67-72.
- Naseri N, Valizadeh H, Zakeri-Milani P. Solid lipid nanoparticles and nanostructured lipid carriers: structure, preparation and application. Adv Pharm Bull. 2015; 5(3): 305–13.
- Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines—a new era in vaccinology. Nat Rev Drug Discov. 2018;17(4):261-79.
- Zhang C, Maruggi G, Shan H, Li J. Advances in mRNA vaccines for infectious diseases. Front Immunol. 2019;10:594. DOI: 10.3389/fimmu.2019.00594
- Jahanafrooz Z, Baradaran B, Mosafer J, Hashemzaei M, Rezaei T, Mokhtarzadeh A, et al. Comparison of DNA and mRNA vaccines against cancer. Drug Discov Today. 2020;25(3):552-60.
- Chakraborty C, Sharma AR, Bhattacharya M, Lee S-S. From COVID-19 to cancer mRNA vaccines: moving from bench to clinic in the vaccine landscape. Front Immunol. 2021;12:2648. DOI: 10.3389/fimmu.2021.679344