NanoMicrobiol NanoBiotechnol, 2022 (2), 202223
DOI:
Review
Iron oxide nanoparticles in medicine
Hamidreza Ramezani 1 and Mohammad Javad Raee 2*
1 Department of Pharmaceutical Biotechnology, School of Pharmacy, Shiraz University of Medical Sciences
2 Center for Nanotechnology in Drug Delivery, Shiraz University of Medical Sciences, Shiraz, Iran
* Coresponding Authour: email addres: raeem@sums.ac.ir
Abstract
Due to unique physical, chemical, and biological properties of iron oxide nanoparticles, these particles have retained key applications in science and technology. Recent developments in nanotechnology and techniques for the fabrication of nanostructures provide various process and protocols for the synthesis of iron oxide nanoparticles. Developments in the synthesis of iron oxide nanoparticles resulted in biocompatible nanoparticles that can be employed in medicine. In the current review, we discuss the most common approaches for the synthesis of iron oxide nanoparticles and their current applications in medicine.
Keywords: Iron nanoparticles; Iron oxide nanoparticles; Medical applications; Nanoparticles fabrication; Nanoparticles Synthesis
1 مقدمه
فناوری نانو واژﻩاي اﺳﺖ که ﺑﻪ ﺗﻤﺎم ﻓﻨﺎوري هـﺎي ﭘﻴـﺸﺮﻓﺘﻪ در ﻋﺮﺻـﻪ کار ﺑـﺎ مواد در ﻣﻘﻴـﺎس ﻧـﺎﻧﻮ اﻃﻼق ﻣﻲﺷﻮد. ﻣﻨﻈﻮر از ﻣﻘﻴﺎس ﻧﺎﻧﻮ اﺑﻌﺎدي بین 1 تا 100 نانومتر ﻣﻲﺑﺎﺷـﺪ. ﺗﻔﺎوت اﺻﻠﻲ ﻓﻨﺎوري ﻧﺎﻧﻮ ﺑﺎ ﻓﻨﺎوري هاي دﻳﮕﺮ در ﻣﻘﻴﺎس ﻣـﻮاد و ﺳـﺎﺧﺘﺎرهاﻳﻲ اﺳـﺖ که در اﻳـﻦ ﻓﻨﺎوري ﻣﻮرد اﺳﺘﻔﺎدﻩ ﻗﺮار ﻣﻲ ﮔﻴﺮﻧﺪ. اﻟﺒﺘﻪ ﺗﻨﻬﺎ کوﭼﻚ ﺑﻮدن اﻧﺪازﻩ ﻣﺪ ﻧﻈﺮ ﻧﻴﺴﺖ؛ ﺑﻠﻜﻪ هنگامی که اﻧـﺪازﻩ ﻣﻮاد دراﻳﻦ ﻣﻘﻴﺎس ﻗﺮار ﻣﻲ ﮔﻴﺮد، ﺧﺼﻮﺻﻴﺎت ذاﺗﻲ ﺁن ها از ﺟﻤﻠﻪ رﻧﮓ، اﺳـﺘﺤﻜﺎم، ﻣﻘﺎوﻣـﺖ و پایداری ﺗﻐﻴﻴﺮ ﻣﻲ ﻳﺎﺑﺪ (1). نانوذرات نانوموادی هستند كه هر سه بعد آن ها در حدود 1 تا 100 نانومتر باشد. اخیراً کاربرد فناوری نانو و موادی در مقیاس نانو، به ویژه نانوذرات مغناطیسی، افزایش یافته و توجه بسیاری از جوامع تحقیقاتی و صنعتی را در بخش های شیمیایی، زیستی و پزشکی به خود جلب کرده است. به عنوان مثال، نانوذرات مغناطیسی عملکرد امیدبخشی در کاهش آلاینده ها و یا کاهش سمیت ها از خود نشان داده اند. به همین ترتیب، در حوزه های پزشکی و دارویی استفاده از فناوری نانو رشد قابل توجهی داشته است. هم اکنون کاربردهای پزشکی و دارویی نانوذرات از دارورسانی هدفمند و هایپرترمیا در درمان سرطان تا مکمل های دارویی و ترکیبات مورد استفاده در تصویر برداری های پزشکی گسترش یافته است (2, 3).
1.2 نانوذرات
يك نانوذره، ذره اي در ابعاد حدود ١ تا ١٠٠ نانومتر، همراه با لایه بین سطحی اطراف می باشد. لایه بین سطحی بخشی جدایی ناپذیر از ماده در مقیاس نانو است که اساساً بر تمام خصوصیات آن تأثیر می گذارد. لایه بین سطحی معمولاً از یون ها، مولکول های غیر آلی و آلی تشکیل شده است (4). در فناوری نانو، ذره به عنوان یک جسم کوچک تعریف می شود که با توجه به خصوصیات آن به عنوان یک واحد کامل رفتار می کند (5). مطابق مشخصات فنی ISO 80004، یک نانوذره به عنوان نانو شی با هر سه بعد بیرونی در مقیاس نانو تعریف می شود، که طولانی ترین و کوتاه ترین بعد تفاوت چندانی با یکدیگر ندارند (6). نانوذرات می توانند دارای خواص مرتبط با اندازه باشند که به طور قابل توجهی متفاوت از ذرات غیر نانو یا مواد بالک هستند.
1.3 نانوذرات مغناطیسی
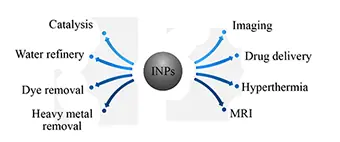
نانوذرات مغناطیسی ذراتی در ابعاد نانو هستند که خاصیت مغناطیسی ویژه ای را بروز می دهند (7, 8). خاصيت مغناطيسي از جمله خواصي است که تا حدود بسيار زيادي به اندازهي ذره وابسته است. در بین انواع نانو ذرات، ذرات مغناطیسی به دلیل جداسازی آسان توسط یک میدان مغناطیسی خارجی و ظرفیت بالای آنها برای استفاده در زمینه های گوناگون مانند ابزار ذخیره اطلاعات، تصویر برداری پزشکی، اصلاح آلودگی های زیست محیطی، دارورسانی و كاتاليستها مورد توجه قرار گرفته اند (9). در دو دهه اخیر استفاده از نانوذرات مغناطیسی در مصارف گوناگون گسترش یافته است. نانوذرات مغناطیسی با ویژگی های سطحی مناسب به طور وسیع در مواردی چون ام.آر.آی، ترمیم بافت های بدن، سنجش های ایمونولوژیک، سم زدایی مایعات بیولوژیک، حرارت درمانی، تنظیم رهایش دارو و حذف آلاینده ها مورد استفاده قرار گرفته اند (10-12). تمام این مصارف زیست پزشکی و زیست مهندسی به نانوذراتی با قدرت مغناطیسی بالا، اندازه زیر 100 نانومتر و توزیع اندازه ذره ای محدود نیاز دارند که خواص فیزیکی و شیمیایی همسانی داشته باشند. علاوه بر آن در کاربردهای زیست پزشکی نیاز است تا نانوذرات دارای پوشش های سطحی خاص نیز باشند. این پوشش های سطحی نه تنها باید غیرسمی و زیست سازگار باشند، بلکه باید اجازه یک رهایش هدفمند را فراهم نموده و تجمع ذرات را در یک منطقه خاص امکان پذیر نمایند (13).
نانوذرات مغناطیسی بر پایه آهن دارای ویژگی های برجسته دیگری در زمینه های زیست پزشکی می باشند. این نانوذرات می توانند به داروها، آنزیم ها، آنتی بادی ها یا نوکلئوتیدها متصل شوند و توسط یک میدان مغناطیسی خارجی به سمت یک ارگان، بافت یا تومور هدف گیری شوند. همچنین این نانوذرات قادر هستند تا جهت استفاده در حرارت درمانی تحت میدان مغناطیسی خارجی گرم شوند. حساسیت نانوذرات مغناطیسی به میدان های مغناطیسی خارجی این امکان را فراهم می آورد تا با بکارگیری یک میدان مغناطیسی بتوان این نانوذرات را در محیط های مختلف هدایت و جهت دهی نمود (14).
به طور کلی مواد بر اساس خواص مغناطیسی و نوع مغناطیس در پنج دسته ی؛ دیامغناطیس (Diamagnetism)، پارامغناطیس (Paramagnetism)، فرومغناطیس (Ferromagnetism)، آنتی فرومغناطیس(Anti-Ferromagnetism) و فری مغناطیس (Ferrimagnetic). قرار می گیرند. این خواص برگرفته از جهت گیری اسپین ها و گشتاور مغناطیسی اتم ها و نوع پاسخگویی آنها در میدان مغناطیسی اعمال شده، می باشد. با توجه به اثرات اندازه، مانند نسبت سطح به حجم، نانوذرات مغناطیسی خواص متفاوتی نسبت به حال بالک (توده ای) بروز می دهند.
امروزه نانوذرات مغناطیسی اکسید آهن با استقبال بیشتری نسبت به سایر نانوذرات رو به رو شده اند. این نانوذرات شامل فریتها با فرمول شیمیایی کلی MFe2O4 (که M میتواند یک کاتیون دو ظرفیتی مثل Co، Ni،Mg وZn باشد)، مگنتیت (Fe3O4) و مگهمیت (Fe2O3) میباشند (15, 16). در این میان نانوذرات مگنتیت(Fe3O4) بهدلیل خاصیت سوپر پارامغناطیسی، بیشتر از سایر اکسید های آهن مورد توجه قرار گرفته اند (17). مگنتیت دارای ساختار کریستالی اسپینل معکوس است که در آن هر سلول واحد، شامل 32 اتم اکسیژن است. اتم های اکسیژن موجود در ساختار مگنتیت در آرایش ساختاری Face Center Cubic (FCC) قرار دارند. طول لبه سلول واحد برابر 839/0 نانومتر است. در این ساختار کریستالی یون های Fe(II) و نیمی از یون های Fe(III) محلهای اکتاهدرال را اشغال میکنند. نصف دیگر یونهای Fe(III) در محل تتراهدرال قرار میگیرند. اتم های آهن دو ظرفیتی بهدلیل داشتن انرژی پایداری میدان بلور Crystal Field Stabilization Energy (CFSE) بالا، ترجیح میدهند تا محل های اکتاهدرال را اشغال کنند. این در حالی است که یون های Fe(III) در صورت قرار گرفتن در هر کدام از محل های اکتاهدرال یا تتراهدرال انرژی پایداری میدان بلور برابر با صفر را خواهند داشت. ساختار کریستالی مگنتیت مسئول خصوصیات مغناطیسی و رنگ مشاهده شده برای آن است. رنگ سیاه مگنتیت از انتقال بار بین یونهایFe(II) و Fe(III) در ساختار کریستالی آن حاصل میشود. خصوصیات مغناطیسی آن نیز ناشی از نحوهی قرارگیری اتم های Fe(II) و Fe(III) در محل های اکتاهدرال و تتراهدرال است (18).
1.3.2 سنتز نانوذرّات مغناطيسی
روشهاي سنتزي متعدّدي براي تهیهی نانوذرّات مغناطيسي توسط محققان گزارش شده است. بارزترین آنها برای ساخت نانوذرات آهن شامل موارد زیر می باشد.
1.3.2.1 سنتز نانوذرات آهن مغناطیسی بهروش رسوبدهی
روش هم رسوبی سادهترین و کارآمد ترین روش شیمیایی برای سنتز نانوذرات مغناطیسی (اکسید های فلزی و فریت ها) می باشد. مزیت اصلی هم رسوبی، توانایی آن در سنتز مقدار زیادی از نانوذرات است. هرچند، کنترل توزیع اندازه ذرات در این روش محدود است و فاکتورهای سینتیکی رشد ذرات را کنترل میکنند. فرآیند هم رسوبی، شامل دو مرحله است. زمانی که غلظت گونه ها به یک حد فوق اشباع میرسد مقدار کمی هسته زایی رخ میدهد و سپس رشد تدریجی هسته ها (با نفوذ حل شونده ها بر روی سطح ذرات) صورت میپذیرد (19). در این روش نانوذرات مغناطیسی آهن (-Fe2O3γ و Fe3O4) با استفاده از نمک های محلول +Fe2 و +Fe3 در اثر هیدرولیز قلیایی به دست میآیند. اندازه، شکل و ساختار نانوذرات بدست آمده به نوع نمک به کار رفته، نسبت +Fe2 به +Fe3، دمای واکنش و قدرت اسیدی محیط وابسته است. سنتز نانوذرات اکسید آهن و فریت ها در محیط آبی و به روش همرسوبی از طریق واکنش شماره یک صورت میگیرد.
M2+ + 2Fe3+ + 8OH– → MFe2O4 + 4H2O Eq. 1
که در آن M+2 میتواند عناصر متفاوتی از جمله +Fe2+, Mn2+, Co2+, Cu2+, Mg2+, Zn2+ و یا Ni+2 باشند (20).
1.3.2.2 سنتز نانوذرات آهن مغناطیسی بهروش هیدروترمال
در این روش برای سنتز اکسید آهن از پیش مادههای آلی فلزی نظیر کربنات های آهن و یا استیل استونات آهن دارای زنجیره بلند کربن، با گروه عاملی کربوکسیلیک یا آمین استفاده میشود. واکنش هیدرو ترمال در مجاورت سورفاکتانت و در دمای بالاتر از 200 درجه سانتی گراد و فشار بیشتر از 14 بار صورت میگیرد. از مزایای این روش میتوان به باریک بودن محدوده توزیع اندازه ذرات، لخته نشدن کریستالها بهدلیل حضور عوامل پایدارکننده، خلوص و چگالی بالا اشاره کرد (20).
1.3.2.3 سنتز نانوذرات آهن مغناطیسی بهروش تجزیه حرارتی
نانوذرات مغناطیسی آهن که در تهیه نانوبلورهای نیمههادی کاربرد دارند، معمولاً از روش تجزیه حرارتی (Thermal decomposition) در حلالهای آلی تهیه میشوند (21). برای این منظور یک ترکیب آلی آهن در یک حلال آلی با دمای جوش بالا حل شده و سپس در حضور یک ماده فعالکننده سطحی در دمای بالا تجزیه میشود. پیشماده آلی فلزی معمولا نمک استیل استونات آهن یا یک کمپلس کربونیلدار است. از اسیدهای چرب، اولئیک اسید و هگزادسیل آمین بهعنوان ماده فعالکننده سطحی استفاده میشود. اندازه ذرات بدست آمده از این روش بسته به دما و نوع حلال متغیر است. با استفاده از روش تجزیه حرارتی نانوذرات مغناطیسی آهن با ظرفیت صفر نیز تهیه شده است. مزیت نانوذرات آهن صفر، بالاتر بودن قدرت مغناطیسی در مقایسه با اکسیدهای آهن مغناطیسی است (22).
1.3.2.4 سنتز نانوذرات آهن مغناطیسی بهروش میکروامولسیون
میکروامولسیون یک فاز پایدار ترومودینامیکی است که از دو مایع غیر قابل امتزاج به دست میآید. در میکروامولسیون آب در روغن، قطرات بسیار ریز آب (nm 50-1) که بوسیله مولکولهای ماده فعالکننده سطحی احاطه شده در حلال آلی قراردارد. در این روش میتوان گفت میکروامولسیون مانند یک میکرو راکتور باعث تشکیل نانوذرات مغناطیسی و جلوگیری از رشد بلور آنها میشود. در نهایت با اضافه کردن یک حلال آلی دیگر امولسیون از بین رفته و نانوذرات مغناطیسی تهیه شده با صاف کردن یا سانتریوفوژ جدا میشوند.
1.3.3 کاربرد نانوذرات اکسید آهن
نانوذرات مگنتیت که از یک هسته معدنی اکسید آهن زیست سازگار تشکیل شدهاند، به دلیل ویژگیهای منحصر بهفرد نانوذرات مگنتیت، نظیر توانایی پاسخ گویی به میدان مغناطیسی خارجی و نیز نسبت سطح به حجم بالا توجهات بسیاری را در حوزههایی نظیر دارورسانی هدفمند، تصویربرداری سلولی، طراحی کاتالیزور برای واکنشهای آلی و تصفیه آب و پساب به خود جلب کردهاند.
1.3.3.1 کاربرد نانوذرات اکسید آهن درحوزه پزشکی
1.3.3.1.1 دارو رسانی هدفمند
سمیت پایین و زیست سازگاری بالای نانوذرات مگنتیت منجر به گسترش کاربرد نانوذرات مگنتیت در دارورسانی هدفمند شده است. با استفاده از میدان مغناطیسی خارجی نانوذرات میتوانند به بافت مورد نظر هدایت شده و دارو را در محل هدف آزاد کنند. انتقال هدفمند دارو منجر به کاهش اثرات جانبی دارو در بافتهای سالم اطراف شده همچنین دوز داروی مورد نیاز جهت تجویز را کاهش میدهد. برای افزایش زیست سازگاری نانوذرات مگنتیت جهت استفاده در حوزه دارورسانی، نانوذرات مگنتیت بهوسیلهی پوششهای آلی یا معدنی اصلاح میشوند (19). پوشش نانوذرات مگنتیت با ترکیب مناسب میتواند بارگذاری، تحویل دارو و نیز آزادسازی آن را کنترل کند. علاوه بر این پوششهای مناسب میتوانند از سمیت نانوذره کاسته و منجر به افزایش زیست سازگاری آن شوند. پوشش نانوذرات مگنتیت با پلیمرها یک روش ایدهآل در دارورسانی است؛ زیرا علاوه بر کاهش سمیت حامل، از لخته شدن نانوذرات مگنتیت نیز جلوگیری میکند (23). به عنوان مثال طی تحقیقی، زهره و همکارانش نانوذرات مگنتیت پوشش داده شده با کوپلیمر زیست سازگار را تهیه کردند و روند بارگذاری و آزادسازی داروی دوکسوروبیسین را مورد بررسی قرار دادند و مطالعات آنها نشان داد که سیستم تهیه شده توانایی آزادسازی کنترل شده را دارد (24).
1.3.3.1.2 گرمادرمانی
یکی دیگر از کاربردهای نانوذرات مگنتیت در حوزهی پزشکی، درمان سلولهای سرطانی با روش گرمادرمانی است. برای نابودی سلولهای سرطانی با روش گرمادرمانی لازم است که دمای بافت مورد نظر افزایش یابد. در این روش درمانی، بیمار تحت تابش امواج الکترومغناطیسی غیر یونیزهکننده قرار میگیرد و این تابش امواج سبب افزایش دما در بافت تومور میشود. از آنجا که سلولهای سرطانی نسبت به سلولهای سالم به افزایش دما حساستر هستند، نابودی انتخابی سلولهای سرطانی اتفاق میافتد (25). تابش الکترومغناطیسی که در روش گرمادرمانی مورد استفاده قرار میگیرد، در محدودهی فرکانس امواج رادیویی قرار دارد. این ناحیه از تابش کاملاً بیضرر بوده و میتواند به اعماق بدن نفوذ کند. حساسیت بالاتر سلولهای سرطانی به دمای بالاتر از 42 درجه سانتی گراد باعث میشود که فرآیندهای آنزیمی طبیعی که سلولها را زنده نگه میدارد، مختل و مرگ سلولهای سرطانی رخ دهد. برای این کاربرد لازم است که از نانوذرات سوپرپارامغناطیس استفاده شود؛ در این صورت با حذف میدان مغناطیسی خارجی، مغناطیسی شدن نانوذرات صفر می شود و لخته شدن نانوذرات درون سیستم گردش خون اتفاق نمیافتد. بهعلاوه مغناطیسی شدن اشباع تاحد امکان باید زیاد باشد تا بتواند گرمای مورد نیاز برای فرایند گرمادرمانی را ایجاد کند (26).
1.3.3.1.3 تصویربرداری رزونانس مغناطیسی (MRI)
تصویربرداری رزونانس مغناطیسی یک روش مفید برای تصویربرداری از بافتهای بدن، بدون استفاده از تابش یونیزهکننده و یا رادیواکتیو است. نانوذرات مغناطیسی اکسید آهن میتوانند بهمنظور تصویربرداری پزشکی مورد استفاده قرار گیرند. استفاده از نانوذرات مگنتیت به عنوان عامل کنتراست درمقایسه با ذرات پارامغناطیس متداول باعث افزایش سرعت آسایش پروتون میشوند. از این رو مقدار کمتری از یک عامل سوپرپارامغناطیس نسبت به عامل پارامغناطیس برای افزایش وضوح تصویر مورد نیاز است. پارامترهایی همچون شکل نانوذره و میزان پوشش آن عوامل تأثیرگذار در رفتار مغناطیسی ذرات هستند. اندازهی ذره ای در مقیاس نانومتر برای اکسید آهن منجر به افزایش نسبت سطح به حجم و به تبع آن افزایش انرژی سطحی نانوذره میشود. از سوی دیگر دستیابی به رفتار مناسب نانوذرات در محیط درون تنی نیازمند پوشش دهی مناسب نانوذره است. ترکیبات زیادی نظیر دکستران، کیتوسان، پلی اتیلن گلیکول و دیگر پلیمرها به منظور پوشش برای نانوذرات مغناطیسی استفاده شده و در تصویربرداری رزونانس مغناطیسی، مورد استفاده قرار گرفتهاند (27).
1.3.3.2 کاربرد نانوذرات اکسید آهن درحوزه های غیر پزشکی
قابلیت بازیابی و استفاده مجدد از کاتالیزورهای همگن در نتیجه اتصال آنها به یک پایه بهگونهای که از فعالیت کاتالیزور نیزکاسته نشود، امروزه تبدیل به یکی از زمینه های مهم تحقیقات در طراحی کاتالیزور واکنشهای شیمیایی شده است. اگرچه کاتالیزور حاصل از اتصال کاتالیزور هموژن به پایه پلیمری یا ترکیبات معدنی هردو مزایای کاتالیزور همگن و ناهمگن را دارد، عمدتاً در نتیجه اتصال از فعالیت کاتالیزور کاسته میشود. از این رو تلاشها برای رفع این مشکل منجر به استفاده از نانوذرات مگنتیت به عنوان پایه برای کاتالیزورهای همگن شده است. نانوذرات مگنتیت به دلیل دارابودن نسبت سطح به حجم بالا و سطح تماس وسیعی که با واکنشگرها خواهند داشت، سرعت واکنش را افزایش میدهند. همچنین درنتیجه ی استفاده از مگنتیت به عنوان پایه، کاتالیزور نهایی دارای خاصیت مغناطیسی خواهد بود و به راحتی تحت تأثیر میدان مغناطیسی خارجی میتواند از محیط واکنش جدا شود. این کاتالیزورها در طیف گستردهای از واکنشهای کاتالیزوری همچون هیدروژندار کردن، اکسایش، واکنشهای تشکیل پیوند C-C ،C-S ،C-N و حلقه زایی استفاده شده است.
آلودگی آب بهوسیلهی فلزات سنگین و رنگ ها به دلیل اثرات نامطلوب آن بر سیستمهای زیست محیطی و سلامت انسان تبدیل به یک مشکل جدی شده است. فلزاتی مانند سرب، کروم، جیوه و آرسنیک نمونهای از فلزات سنگین هستند که حتی در غلظتهای پایین هم برای موجودات زنده سمی هستند. آلوده شدن آب با آلایندههای رنگی خطر مرگ آبزیان و احتمال سرطان برای انسان را در پی دارد. فناوریهای گوناگونی نظیر رسوب دهی شیمیایی، تبادل یون و جذب سطحی برای حذف فلزات سنگین و رنگها توسعه داده شدهاند. در بین این روشها، جذب متداولترین روش برای حذف آلاینده می باشد. در بین جاذب های استفاده شده، نانوذرات مغناطیسی به علت مزایایی نظیرکارایی بالا، قابلیت بازیابی سریع، سطح وسیع، حمل و نقل راحت و هزینهی پایین توجه زیادی را به خود جلب کردهاست (28). به عنوان نمونه سان و همکارانش نانوذرات مگنتیت اصلاح شده با 3-آمینوپروپیل تری اتوکسی سیلان را تهیه کردند و توانایی حذف رنگ مالاشیت سبز را مورد بررسی قرار دادند. نتایج نشان داد که ترکیب تهیه شده، کارایی بالایی را برای حذف مالاشیت سبز نسبت به مگنتیت اصلاح نشده نشان میدهد (29).
تقدیر و تشکر
این مطالعه تحت حمایت دانشگاه علوم پزشکی شیراز انجام گرفته است.
منابع
-
- Masserini M. Nanoparticles for brain drug delivery. ISRN biochemistry. 2013;2013.
- Zhao C-Y, Cheng R, Yang Z, Tian Z-M. Nanotechnology for cancer therapy based on chemotherapy. Molecules. 2018;23(4):826.
- Karami-Darehnaranji M, Taghizadeh S-M, Mirzaei E, Heidari R, Berenjian A, Ebrahiminezhad A. Bio-Assisted Synthesis of Food-Grade FeOOH Nanoellipsoids as Promising Iron Supplements for Food Fortification. Applied Food Biotechnology.8(1):71-7.
- Vert M, Doi Y, Hellwich K-H, Hess M, Hodge P, Kubisa P, et al. Terminology for biorelated polymers and applications (IUPAC Recommendations 2012). Pure and Applied Chemistry. 2012;84(2):377-410.
- Batista CAS, Larson RG, Kotov NA. Nonadditivity of nanoparticle interactions. Science. 2015;350(6257):1242477.
- Klaessig F, Marrapese M, Abe S. Current perspectives in nanotechnology terminology and nomenclature. Nanotechnology Standards: Springer; 2011. p. 21-52.
- Gabizon AA. Selective tumor localization and improved therapeutic index of anthracyclines encapsulated in long-circulating liposomes. Cancer Res. 1992;52(4):891-6.
- Rotariu O, Strachan NJC. Modelling magnetic carrier particle targeting in the tumor microvasculature for cancer treatment. Journal of Magnetism and Magnetic Materials. 2005;293(1):639-46.
- Wu W, Wu Z, Yu T, Jiang C, Kim W-S. Recent progress on magnetic iron oxide nanoparticles: synthesis, surface functional strategies and biomedical applications. Science and technology of advanced materials. 2015;16(2):023501.
- Mahdavi M, Ahmad M, Haron M, Namvar F, Nadi B, Rahman M, et al. Synthesis, surface modification and characterisation of biocompatible magnetic iron oxide nanoparticles for biomedical applications. Molecules. 2013;18(7):7533-48.
- Avilés MO, Ebner AD, Ritter JA. In vitro study of magnetic particle seeding for implant assisted-magnetic drug targeting. Journal of Magnetism and Magnetic Materials. 2008;320(21):2640-6.
- Aburto RR, Sokolov K, Kulp AM, Vreeland EC, Lu Z, Bast RC, et al. Magnetic relaxometry detection of stealth, antibody-targeted micellar iron oxide nanoparticles in-vivo. AACR; 2017.
- Gupta AK, Gupta M. Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications. Biomaterials. 2005;26(18):3995-4021.
- Gao Y, Liu Y, Xu C. Magnetic nanoparticles for biomedical applications: From diagnosis to treatment to regeneration. Engineering in Translational Medicine: Springer; 2014. p. 567-83.
- Torchilin VP. Nanoparticulates as drug carriers: Imperial college press; 2006.
- Hyeon T. Chemical synthesis of magnetic nanoparticles. Chem Commun. 2003(8):927-34.
- Mohapatra M, Anand S. Synthesis and applications of nano-structured iron oxides/hydroxides–a review. International Journal of Engineering, Science and Technology. 2010;2(8).
- Roonasi P. Adsorption and surface reaction properties of synthesized magnetite nano-particles: Luleå tekniska universitet; 2007.
- Laurent S, Bridot J-L, Elst LV, Muller RN. Magnetic iron oxide nanoparticles for biomedical applications. Future medicinal chemistry. 2010;2(3):427-49.
- Laurent S, Forge D, Port M, Roch A, Robic C, Vander Elst L, et al. Magnetic iron oxide nanoparticles: synthesis, stabilization, vectorization, physicochemical characterizations, and biological applications. Chem Rev. 2008;108(6):2064-110.
- Amara D, Felner I, Nowik I, Margel S. Synthesis and characterization of Fe and Fe3O4 nanoparticles by thermal decomposition of triiron dodecacarbonyl. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2009;339(1-3):106-10.
- Vasylenko IV, Kolotilov SV, Kotenko IE, Gavrilenko KS, Tuna F, Timсo GA, et al. Magnetic properties of nanosized γ-Fe2O3 and α-(Fe2/3Cr1/3)2O3, prepared by thermal decomposition of heterometallic single-molecular precursor. J Magn Magn Mater. 2012;324(4):595-601.
- Mou X, Ali Z, Li S, He N. Applications of magnetic nanoparticles in targeted drug delivery system. Journal of nanoscience and nanotechnology. 2015;15(1):54-62.
- Zohreh N, Hosseini SH, Pourjavadi A. Hydrazine-modified starch coated magnetic nanoparticles as an effective pH-responsive nanocarrier for doxorubicin delivery. Journal of Industrial and Engineering Chemistry. 2016;39:203-9.
- Renard P-EL, Buchegger F, Petri-Fink A, Bosman F, Rüfenacht D, Hofmann H, et al. Local moderate magnetically induced hyperthermia using an implant formed in situ in a mouse tumor model. International Journal of Hyperthermia. 2009;25(3):229-39.
- Bañobre-López M, Teijeiro A, Rivas J. Magnetic nanoparticle-based hyperthermia for cancer treatment. Reports of Practical Oncology & Radiotherapy. 2013;18(6):397-400.
- Revia RA, Zhang M. Magnetite nanoparticles for cancer diagnosis, treatment, and treatment monitoring: recent advances. Materials Today. 2016;19(3):157-68.
- Namvari M, Namazi H. Clicking graphene oxide and Fe 3 O 4 nanoparticles together: an efficient adsorbent to remove dyes from aqueous solutions. International Journal of Environmental Science and Technology. 2014;11(6):1527-36.
- Sun L, Hu S, Sun H, Guo H, Zhu H, Liu M, et al. Malachite green adsorption onto Fe 3 O 4@ SiO 2-NH 2: isotherms, kinetic and process optimization. RSC Advances. 2015;5(16):11837-44.