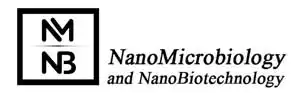NanoMicrobiol NanoBiotechnol, 2023 (1), 202312
DOI:
Review
Bio-nanotechnology and applications of biological nanostructures in medicine
Maryam Jeddi
Department of Medical Nanotechnology, Shiraz University of Medical Sciences, Shiraz, Iran
* Correspondence: maryam.jedi7575@gmail.com
Abstract
Bio-nanotechnology has emerged as a novel technology that was resulted by combination of nanotechnology and biotechnology. In this most novel technology, biological blocks such as nucleic acids, phospholipids, proteins, and biopolymers are employed to fabricate nanostructures. These bio-nanostructures can be considered as the safest nanostructures with unpresented features and capabilities that enable us to do what we cannot do previously. In the current review paper the most common bio-nanostructures that were developed in the bio-nanotechnology were provided. DNA origami is one the most first bio-nanostructures that were developed by using DNA molecules. Using DNA pairing rule, 2D or 3D nanostructures can be fabricated by DNA molecules. These structures can be designed to be static or dynamic and act as a smart carrier. Self-assembling nanostructures is one of the most interesting and also complicated field in nanotechnology. But these nanostructures can simply be achieved via bio-nanotechnology. Self-assembling bio-nanostructures are now available as amphiphilic structures, self-assembled peptides, Lego peptides, and S layer. Protein cages is the other interesting field in bio-nanotechnology. Protein cages can provide valuable boxes to be loaded with therapeutics. These cages are simply available as biomolecules such as ferritin, heat shock proteins (HSPs), and chaperons.
Keywords: Biomolecules; Biological nanostructures; DNA origami; Drug delivery; Self assembled nanostructures
بیونانوتکنولوژی، مفهوم و تکنیکهای زیستشناسی مولکولی را برای اهداف مهندسی به کار میگیرد و دستگاههایی را در مقیاس نانو تولید میکند. بنابراین به ما توانایی تقلید از ساختارهای بیولوژیکی را با دقت در سطح مولکولی میدهد. تشخيص و درمان زودهنگام با پيشرفت بيونانو تكنولوژيكي امكانپذير شده است. این واقعاً یک مسئله مهمی است زیرا اگر پزشکان بتوانند به موقع بیماری ها را تشخیص دهند، می توان جان بسیاری از بیماران مبتلا به شرایط و بیماری های کشنده را نجات داد. اعتقاد بر این است که اکتشافات جدید در بیونانوتکنولوژی بشر را شگفت زده خواهد کرد. پیش بینی می شود که این فناوری توانایی بشر را برای مدیریت عرصه های مختلف از جمله تولید مواد، پزشکی، داروسازی، بیوتکنولوژی، کشاورزی، محیط زیست، مواد غذایی و تولید لوازم آرایشی و بهداشتی تغییر دهد. ذرات بیونانو را می توان توسط پلیمرهای زیستی، ویروس ها، اسیدهای نوکلئیک، آنتی بادی ها یا سایر پروتئین ها برای کمک به کاربردهای تشخیصی و درمانی فعال کرد. در حالت کلی بیونانوتکنولوی یعنی نانوفناوری ای که از قابلیت مواد زیستی جهت طراحی و ساخت ساختارهای نانومتری استفاده می کند(1, 2).
اسید نوکلئیک در بیونانوتکنولوژی
همانطور که میدانیم DNA یک مارپیچ دوتایی است که در آن دو زنجیره بلند به صورت مارپیچ به دور یک محور مشترک پیچیده میشوند تا DNA دو رشتهای (dsDNA) تولید کنند که به عنوان حامل اطلاعات ژنتیکی شناخته میشود. بسیاری از مطالعات نشان میدهند که DNA یک ماده بالقوه برای ساخت نانوساختارها و دستگاههای در مقیاس نانو است. به دلیل ساختار مارپیچ دو رشته ای، DNA به عنوان مهمترین ماده در کاربردهای خودآرایی در نظر گرفته می شود(1, 3-5).
DNA Origami
دیانای اوریگامی به فناوری ساختن اشکالی خاص از مولکول DNA در فضای دو یا سه بعدی در مقیاس نانو گفته میشود.که اولین بار آقای Seeman در سال 1980نوکلئیک اسیدها را به وسیله جفت کردن بازهای مکمل کنار هم قرار داد و یک دی ان ای اوریگامی ساخت. علت استفاده از رشته DNA در این فناوری آن است که اجزا تشکیلدهنده دیانای که همان نوکلئوتیدها آدنین، گوانین، سیتوزین و تیمین هستند، میتوانند دوبهدو با یکدیگر پیوندهای هیدروژنی مستحکمی تشکیل دهند.
در حالت کلی نانوفناوری DNA به دو شاخه ایستا و پویا تقسیم میشود(1, 3-5). در شاخه ایستا، سنتز ساختارهایی انجام میشود که در حال تعادل و ساکن هستند. این ساختارها شامل ساختارهای دو بعدی و سه بعدی می شوند(1, 3-5). شاخه پویای این فناوری شامل ساختارهایی می شود که غیرتعادلی بوده و به طور مدام در حال تغییر شکل هستند. اساس عمل کرد ساختارهای پویای مانند دیگر ساختارهای بر مبنای اسیدهای نوکلئیک بر جفت شدن بازها و یا هیبریداسیون می باشد. پویایی چنین ساختارهایی را می توان بر مبنای حساسیت و پاسخ به عوامل شیمیایی (مانند فشار اسمزی، غلظت نمک ها، تغییرات pH، حضور آپتامر خاص و …) و یا عوامل فیزیکی (مانند تغییرات نور، دما و…) ایجاد نمود(1, 3-5).
روشهای ساخت DNA Origami
- Scaffold-free DNA
این روش همان روش ابداع شده توسط آقایSeaman است. در این روش آجرهایی از اسیدهای نوکلئیک وجود دارد که انتهای این ساختارها دارای یک باز آزاد است. در مقابل نیز یک ساختار آجر مانند دیگر وجود دارد که نوکلئیک اسید آزاد دیگری نیز در سر این ساختار وجود دارد که این دو سر آزاد مکمل هم هستند. این سرهای آزاد با هم مکمل میشوند و شکلهای متفاوتی میسازند.
- Scaffolded DNA Origami
در این روش از یک زنجیره بلند استفاده میکنند که این زنجیره به وسیله داربستهایی که بین زنجیره قرار میگیرند میتوانند شکلهای گوناگونی داشته باشد. این روش به دلیل دقت بالا و سهولت ساخت، بیشتر مورد استفاده قرار می گیرد. هم اکنون طراحی و ساخت این نانوساختارها با استفاده از نرم افزارهای کامپیوتری با دقت و سهولت بیشتری ممکن شده است. به عنوان مثال نرم افزاری به نام CADNano برای طراحی این ساختارها استفاده می شود(1, 3-5).
ساختارهای ساخته شده توسط DNA Origami
جعبه های DNA
از DNA برای ساختن جعبه هایی که به عنوان حامل عمل میکنند استفاده شده است. اغلب این جعبه ها دارای یک ساختاری مانند قفل هستند و حالت اوریگامی سختی دارند. این ساختارها با قرار گرفتن یک بیومارکر یا مولکول روی قفل باز میشوند و از این طریق میتوانند در دارورسانی کاربرد داشته باشند.
نانوربات های DNA
اثر بخشی این ساختارها را در حمله به تومورها در موش ها و خوک های مبتلا به سرطان بررسی کرده اند. این ربات های نانومتری از DNA ساخته شده اند که خود را دقیقا در زمان و مکان مناسب باز میکنند. عملکرد این ساختارها به این صورت می باشد که مانند یک بسته دی ان ای اریگامی تا شده می باشند که در محل مناسب و در نزدیکی تومورها با برخورد آنتی ژن سرطانی به این ساختارها باز میشوند و این قابلیت را دارند که مولکولهای ترومبین را در خود نگه دارند. لازم به ذکر است که ترومبین آنزیمی می باشد که باعث لخته شدن خون می شود. با گیر افتادن ترومبین ها در محل تومور لخته ایجاد میشود که از این طریق مواد غذایی لازم به سلول های تومور نمیرسد. در نهایت باعث توقف رشد سلول های سرطانی و در نتیجه آپوپتوز تومورها میشوند(1, 3-5).
خودآرایی و بیونانوتکنولوژی
خودآرایی اصطلاحی است که شامل «برهمکنش غیرکووالانسی دو یا چند زیر واحد مولکولی برای تشکیل یک اگرگیت است که ساختار و ویژگیهای جدید آن توسط ماهیت و موقعیت تک تک اجزا تعیین میشود. خودآرایی مولکولها، فرآیند طولانی را که نانوساختار باید در مرتب کردن تک تک مولکولها یا اتمها در یک زمان انجام دهد، حذف میکند. بیونانوتکنولوژی با بهرهگیری از مزایای گسترده فرآیندهای خودآرایی برای ایجاد ساختارهای متنوع در ابعاد نانو با عملکردهای خاص و بسیاری از ویژگیهای جدید مرتبط است. در واقع، خودآرایی بر اساس هیچ الگوی از پیش تنظیم شده ای نیست. در اینجا، به منظور درک عمیق در مورد خودآرایی در بیونانوتکنولوژی، به طور خلاصه برخی از فرآیندهای خودآرایی را شرح میدهیم(1, 6).
خود آرایی آمفیفیل ها
آمفیفیل ها مولکول هایی هستند که دارای یک ناحیه آبگریز (غیرقطبی) و یک ناحیه آبدوست (قطبی) هستند. در محیط های نمکی و یا در نتیجه تغییرات pH، این ساختارها آرایش یافته و یک سری ساختارهای مجزایی مانند میسل ها، وزیکول ها و لوله ها را تشکیل میدهند. یعنی قسمتهای هیدروفوب داخل قرار میگیرند و قسمتهای هیدروفیل به سمت بیرون ساختار آرایش می یابند و از این طریق میتوانند شکلهای مختلفی به وجود آورند(7, 8).
خودآرایی پپتیدها
پپتیدها به عنوان یک ساختار کوتاه با 20 اسید آمینه متعارف، قادر هستند آرایش های متنوع و ساده ای را ایجاد نمایند. به همین جهت ساختارهای پپتیدی به عنوان اجزای همه کاره برای کاربردهای بیونانوتکنولوژی در نظر گرفته می شوند. تشکیل ساختارهای سه بعدی پپتیدی را می توان از طریق تغییر در ساختار پپتید با تنظیم خواص فیزیکوشیمیایی محیط از جمله pH، دما و محتوای نمک کنترل کرد. در ادامه دو مثال معروف از این نوع ارائه شده است(1, 9, 10) .
پپتیدهای لگو
این ساختارها مانند قطعات و آجرهای لگو عمل میکنند. همانطور که میدانیم ساختار پپتیدها به گونه ای است که حالت قطبی و غیر قطبی دارد.که این حالت در ساختار پپتیدها به صورت مداوم تکرار شده است. این ساختارها تحت تغییر شرایط به هم متصل شده و رشته ها را به وجود می آورند. معروفترین این نوع ساختاری به اسم RADA می باشد.که این ساختار دارای 16 آمینواسید و اندازه ای به طول nm5 میباشد.این ساختار زمانیکه در آب قرار میگیرد حل می شود و با اعمال شرایط خاص حالت ژلی به خود میگیرد که از ساختارها میتوان برای ساخت نانوفیبرها استفاده کرد.
خودآرایی ساختار لایه سطحی (S)
لایههای S در اعضای تقریباً هر گروه از طبقهبندی ها، در باکتریهای گرم مثبت و گرم منفی و ارکیها و برخی از جلبکهای سبز یافت میشوند. بسیاری از سویه های باکتری های حقیقی و باکتری های باستانی حاوی ساختارهای پروتئینی منظم به عنوان بیرونی ترین جزء پوشش سلولی خود هستند. این ساختار های کریستالی معمولاً به عنوان لایه های سطحی یا لایه های S نامیده می شوند. اسمبل شدن لایه های S به عنوان سازمان یافته ترین و کارآمدترین سیستم خودآرایی بیولوژیکی در نظر گرفته می شود. اکثر لایه های S یک سطح بیرونی صاف و سطح داخلی موجدار را نشان می دهند. لایه های S شبکه های پروتئینی بسیار متخلخل با تخلخل سطحی 30 تا 70 درصد هستند. این لایههای دوبعدی از شبکههای تک مولکولی از یک پروتئین منفرد یا گونههای گلیکوپروتئین با وزن مولکولی 40 تا 200 کیلو دالتون تشکیل شدهاند. که میتوانند خود را در یک لایه منظم برای تسهیل تعدادی از عملکردهای مهم بیولوژیکی مانند ایجاد حفاظت و واسطه برای تبادل انتخابی مولکول ها جمع کنند(1, 11, 12).
قفس های پروتئینی و بیونانوتکنولوژی
قفس های پروتئینی به طور گسترده به عنوان ساختارهای عملکردی در بیونانوتکنولوژی مورد بررسی قرار می گیرند. این ساختارها را می توان به قفس های غیر ویروسی و ذرات ویروس مانند (VLPs) طبقه بندی کرد. نمونههایی از قفسهای پروتئینی غیر ویروسی عبارت است از فریتینها و چاپرونینها.
اکثر قفس های پروتئینی دارای منافذی در پوسته پروتئینی خود در حد فاصل بین زیر واحدها هستند. قطر این منافذ در ساختارهای مختلف متفاوت است. این منافذ باعث ارتباط حفره داخلی این پروتئینها با محیط بیرونی می شوند. مولکول های کوچک (مانند یون ها، آب و مولکول های آلی) می توانند از طریق این منافذ پخش شوند. بنابراین، منافذ به عنوان دروازه های حذف اندازه عمل می کنند. زیرا مولکول های بزرگتر از اندازه منافذ نمی توانند وارد حفره شوند. در نگاه اول، قفس های پروتئینی اغلب به عنوان ساختارهای ساکن در نظر گرفته می شوند. با این حال، بسیاری از قفس های پروتئینی ماهیت پویا دارند(13). در ادامه به بیان چند نمونه از این ساختارها می پردازیم.
فریتین
فریتین ها قفس های پروتئینی غیر ویروسی هستند که در همه جا در حیوانات، گیاهان و باکتری ها وجود دارند. فریتین پروتئینی کروی و تو خالی است که آهن را در خود ذخیره و در مواقع نیاز بصورت کنترل شده آنرا آزاد میکند. از این رو بدن سیستمی بافری علیه فقر آهن ایجاد کرده است به این صورت که، اگر سطح آهن خون کاهش یابد، بدن فریتین را به درون خون آزاد میکند و اگر سطح آهن درون خون و بافتها خیلی زیاد شود فریتین کمک میکند که این آهن اضافه ذخیره شود. درون این کره پروتئینی، آهن به فرم سه ظرفیتی آن یعنی Fe+3 نگهداری میشود. برای آزاد شدن آهن هنگامی که بدن به آن نیاز دارد آهن سه ظرفیتی باید به آهن دو ظرفیتی یعنی Fe+2 تغییر یابد. پس از انجام این تغییر،Fe+2 از طریق کانالهای این ساختار کروی از آن خارج میشود. فریتینی که با آهن ترکیب نمی شود آپوفریتین نامیده می شود. به اصطلاح به این قفس خالی آپوفریتین (Apo-Fr) میگویند. فریتین و آپوفریتین نانوذرات پایداری هستند و تا دمای 85 درجه سانتیگراد، و در pH بالا مقاومت می کنند. بنابراین، این ساختارها قفس های پروتئینی محبوبی هستند و در مطالعات مختلفی از تحویل دارو گرفته تا سنتز نانوذرات الگو و نانوراکتورها مورد استفاده قرار گرفته اند(13).
پروتئین های شوک حرارتی (Hsps) و چاپرونین ها
سلولها، پروتئینهای شوک حرارتی (Hsps) را در زمانی که تحت فشارهای محیط مانند افزایش دما قرار میگیرند، به میزان بیشتری بیان میکنند. بسیاری از Hsps ها چاپرون هستند، یعنی تا حدی به تاخورده شدن صحیح پروتئین های باز شده کمک می کنند، یا پروتئین های تازه تشکیل شده را تثبیت می کنند. بنابراین، نقش مهمی در محافظت از سلول ها در برابر استرس های محیطی یا فیزیولوژیکی دارند. برخی از Hsps ها ساختار قفس مانندی دارند. قطر 12 نانومتر و حفره ای به قطر5/6 نانومتر دارد.
ساختارهای قفس مانند دیگری که وجود دارد چاپرونینها هستند.آنها کمپلکس های پروتئینی استوانه ای هستند که به اصطلاح دارای اتاقک های تاشو هستند. پروتئین ها در داخل این حفره ها تا می شوند، و از تعامل با سایر پروتئین های باز شده محافظت می شوند. برخلاف اکثر قفسهای پروتئینی دیگر، چاپرونینها دارای منافذ بزرگی هستند که به پروتئینها، درشت مولکولهای مصنوعی و نانوذرات معدنی اجازه ورود و خروج از حفرهها را میدهند. تحت مصرف ATP، زیر واحدها دستخوش تغییرات می شوند که این فرایند درب داخلی را بسته و باز می کند(13).
نتیجه گیری
در سال های اخیر بیونانوتکنولوژی به عنوان یک فناوری جوان که از امتزاج فناوری نانو و فناوری های زیستی حاصل شده است بروز و گسترش یافت. در این فناوری مواد زیستی به عنوان زیرواحدها و اجزاع زیست سازکار جهت ساخت ساختارهای نانو بکارگرفته می شوند. پویایی این ساختارهای زیستی نانومقیاس و توانایی مدیریت آنها در شرایط مختلف یکی از بزرگترین برتری های این ساختارها نسبت به نانوساختارهای متداول می باشد که در فناوری های نانو در دسترس است. این فناوری با ادغام دو فناوری پیشرفته نانو و فناوری های زیستی قادر است پنجره های جدیدی را بر روی دانش و توانایی های بشر بگشاید. این فناوری در زمینه های مختلف و به طور ویژه در علوم پزشکی، داروسازی و زیست پزشکی امید بخش است. با استفاده از این فناوری میتوان زندگی بهتر و کم هزینه تر و مفیدتری را برای بیماران به ارمقان آورد. گمانهزنیهایی وجود دارد که به دلیل همپوشانی نانوتکنولوژی با بیوتکنولوژی، پیشرفتهای بیشتر و بیشتری در این حیطه از فناوری حاصل خواهد شد. به نظر می رسد رویکرد های آتی این فناوری در جهت تحقیقات بیونانوتکنولوژی و پیشرفتهای مرتبط با آن در کاربردهای زیستپزشکی برای ایجاد یک داروی منحصر به فرد، شخصیسازی شده و با کیفیت بالا صورت پذیرد.
فهرست منابع:
- Lee Y-C, Moon J-Y. Introduction to bionanotechnology: Springer; 2020.
- Taylor PM. Biological matrices and bionanotechnology. Philosophical Transactions of the Royal Society B: Biological Sciences. 2007;362(1484):1313-20.
- Saccà B, Niemeyer CM. DNA origami: the art of folding DNA. Angewandte Chemie International Edition. 2012;51(1):58-66.
- Dey S, Fan C, Gothelf KV, Li J, Lin C, Liu L, et al. DNA origami. Nature Reviews Methods Primers. 2021;1(1):1-24.
- Wang P, Meyer TA, Pan V, Dutta PK, Ke Y. The beauty and utility of DNA origami. Chem. 2017;2(3):359-82.
- Chen J, Zou X. Self-assemble peptide biomaterials and their biomedical applications. Bioactive materials. 2019;4:120-31.
- Bull SR, Guler MO, Bras RE, Meade TJ, Stupp SI. Self-assembled peptide amphiphile nanofibers conjugated to MRI contrast agents. Nano Letters. 2005;5(1):1-4.
- Meng Q, Kou Y, Ma X, Liang Y, Guo L, Ni C, et al. Tunable self-assembled peptide amphiphile nanostructures. Langmuir. 2012;28(11):5017-22.
- Hamley IW. Lipopeptides: from self-assembly to bioactivity. Chemical Communications. 2015;51(41):8574-83.
- Subramani K, Khraisat A, George A. Self-assembly of proteins and peptides and their applications in bionanotechnology. Current Nanoscience. 2008;4(2):201-7.
- Pum D, Toca-Herrera JL, Sleytr UB. S-layer protein self-assembly. International journal of molecular sciences. 2013;14(2):2484-501.
- Baneyx F, Matthaei JF. Self-assembled two-dimensional protein arrays in bionanotechnology: from S-layers to designed lattices. Current opinion in biotechnology. 2014;28:39-45.
- Rother M, Nussbaumer MG, Renggli K, Bruns N. Protein cages and synthetic polymers: a fruitful symbiosis for drug delivery applications, bionanotechnology and materials science. Chemical Society Reviews. 2016;45(22):6213-49.