NanoMicrobiol NanoBiotechnol, 2022 (2), 202222
DOI:
Review
Surface Modification of PCL Nanofibrous Scaffolds
Razieh Yaseri 1
1 Department of Medical Nanotechnology, School of Advanced Medical Sciences, Shiraz University of Medical Sciences, Shiraz, Iran
* Correspondence: raziehyaseri@gmail.com
Abstract
By tissue engineering, it is feasible to grow and regenerate the required cells on the scaffolds by making scaffolds similar to the body’s natural matrixes. Electrospinning, is one of the new methods that can be used to construct nanofiber scaffolds. Polycaprolactone is a synthetic polymer with considerable mechanical properties that makes it promising polymer for nanofibrous scaffolds fabrication. Beside valuable physicochemical properties, PCL nanofibrous scaffolds need to be improved in the case of surface features to make them more suitable for biological applications. In order to modify the surface of this hydrophobic polymer, various techniques were developed. After surface modification and coating the scaffolds exhibited improved hydrophilicity that resulting in better attachment, growth, and proliferation of the cells on these scaffolds.
Keywords: Nanofibrous scaffolds; Polycaprolactone; Chitosan; Hyaluronic Acid; Surface modifications
1 مقدمه
شیوه های جدید ساخت داربستهای مهندسی بافت به جهت حل مشکلات پزشکی رایج، کشف و توسعه داده شده است. برای سالیان متمادی، ساخت داربستهای پلیمری به عنوان سوبسترا برای تولید و بازساخت بافت، یکی از محبوبترین و نویدبخشترین راهکارها بوده است. شیوههای تولید نانوفیبرهای پلیمری شامل تکنیکهای جدایی فاز، خودآرایی و الکتروریسی میباشند، و در این میان الکتروریسی سادهترین و موثرترین آنها است (1). الکتروریسی به جهت اینکه این توانایی را به محققان میدهد تا داربستهای پلیمری متخلخل فیبروس (لیف مانند) با اندازه های میکرومتری تا نانومتری و مشابه ماتریکس خارج سلولی بسازند، یک روش محبوب تلقی میشود. به علاوه این روش در مقایسه با روشهای تکنیک جدایی فاز و خودآرایی، نسبتا سریع میباشد. نصب و راه اندازی یک سیستم الکتروریسی آسان است. این فناوری هم برای تولید مقادیر کم در آزمایشگاه و هم تولید انبوه برای مصارف صنعتی مناسب میباشد. این روش میتواند داربست نانوفیبری متخلخل به هم پیوسته دارای پایداری ساختاری و مکانیکی در مقایسه با روش های دیگر ایجاد نماید (2).
ترکیبات مختلفی از جمله پلیمرها، کامپوزیتها و سرامیکها قابلیت الکترریسی دارند (3). پلیمرهای زیست تخریبپذیر شامل پلیمرهای سنتزی همانند پلیلاکتیکاسید (PLA)، پلیگلایکولیکاسید (PGA)، پلیلاکتیککوگلاکولیکاسید (PLGA)، پلیکاپرولاکتون (PCL) و پلیمرهای طبیعی شامل کلاژن، ژلاتین، سیلک و کیتوزان تا به حال در فرآیند الکتروریسی استفاده شدهاند (4). پلیمر پلیکاپرولاکتون خصوصیات مکانیکی بهتری در مقایسه با سایر مواد بیولوژیکی دارد و جالب است که زیست تخریبپذیر بوده و قابل بازجذب نیز دارد. PCL یک پلیاستر خطی آلیفاتیک زیستسازگار و ارزان قیمت است که تائیدیه FDA را دریافت نموده. دارای خواص ویسکوالاستیک است که سبب ایجاد و شکلگیری محدوده وسیعی از داربستها میگردد. علت محدودیت کاربرد پلیمر پلیکاپرولاکتون به عنوان داربست پلیمری، ماهیت هیدروفوبیک آن میباشد که مانع پیشروی و اتصال سلولها به سطح پلیمر میشود. برای حل این مشکل، تکنیکهای اصلاح سطح می تواند راهکار امید بخشی به نظر آید. در این روش ها به وسیله تعدیل کردن سطح و یا پوشش دادن سطح با مواد دیگر میتواند خواص فیزیکی و شیمیایی سطح را تغییر داد (5). در ادامه به بررسی تکنیک های اصلاح سطح در جهت بهبود ویژگی های نانوفیبر های PCL خواهیم پرداخت.
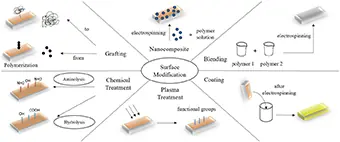
2 اصلاح سطح
علت اینکه محققان به داربستهای الکتروریسی شده علاقمند هستند، کاربردهای زیست پزشکی آنها میباشد. یکی از اهداف اصلی اصلاح سطح داربستها، افزایش آبدوستی این سطوح است. سطوح آبدوست، دارای زیستسازگاری بیشتری هستند و مانع رسوب زیستی میشوند. روش های اصلاح سطح به دو دسته اصلی تقسیم میشوند. دسته اول تیمار حین فرآیند الکتروریسی است که شامل نانوکامپوزیت ها و مخلوط کردن می باشد. دسته دوم تیمار پس از فرآیند الکتروریسی است که شامل پوششدهی، پیوند زدن، تیمار پلاسما و تیمار شیمیایی است.
3 نانوکامپوزیت
اصلاح سطح حین فرآیند الکتروریسی، یک روش تک مرحلهای است. در روش کامپوزیت، به محلول پلیمری، نانوذرات اضافه میشود سپس الکتروریسی صورت میگیرد. این نانوذرات اضافه شده، سبب افزایش سختی سطح فیبرها میشود، به همین دلیل می تواند موجب تقویت ترشوندگی نانوکامپوزیت الکتروریس شده بگردد.
4 مخلوط کردن
در روش مخلوط کردن، یک مخلوط پلیمری شامل دو یا بیشتر از دو پلیمر است که در سطح مولکولی غیرقابل امتزاج میباشند. مخلوط کردن از گذشته تاکنون برای بهبود خواص بالک پلیمرها استفاده می شده است. در این روش هموپلیمرهای هیدروفیل و هیدروفوب و یا آنکه کوپلیمرهای آمفیفیل با هم ترکیب شده و انرژی سطحی و همچنین شرایط کینتیکی طی فرآیند الکتروریسی، بر برونده فرایند تاثیر خواهد گذاشت. بزرگترین عیب این روش پیچیدگی آن میباشد. برای اینکه بتوان دو پلیمر غیرقابل امتزاج را وارد فرآیند الکتروریسی کرد باید از دو محلول برای تهیه محلول پلیمری استفاده کرد که هر دو نیز باید قابل الکتروریسی شدن باشند.
5 پوشش دهی
یکی از روشهای اصلاح پس از فرآیند الکتروریسی، پوششدهی میباشد که به علت تقلید از بافت طبیعی و افزایش آبدوستی و زیستسازگاری داربست در پزشکی کاربرد دارد. جذب فیزیکی ساده که در این روش صورت گرفته است، از طریق پیوندهای بینمولکولی از قبیل واندروالس، پیوند هیدروژنی، نیروی الکترواستاتیک و نیروهای هیدروفوبیک اتفاق میافتد. میزان تمایل بین مواد پوششدهنده مختلف و سطح سوبسترا و در نتیجه نیروی چسبندگی بین آنها متفاوت است و همین امر می تواند تعیین کننده باشد. برای مثال اگر چسبندگی بین ماده پوشش دهنده و سطح سوبسترا پایین باشد، پوشش به آسانی جدا خواهد شد.
6 پیوند زدن
فرآیند پیوند زدن به دو شیوه اصلی رخ میدهد. اول پیوند زدن به (Grafting-to)، در این روش ماکرومولکولها از طریق گروههای عاملی انتهایی خود، به گروههای عاملی روی سطح اتصال مییابند. روش دوم پیوند زدن از (Grafting-from) می باشد که در آن، فرآیند پلیمریزاسیون به طور مستقیم با حضور مونومرها، روی سطح اتفاق میافتد. از روش تیمار پلاسما (که در قسمت بعد توضیح داده خواهد شد) به عنوان مرحله پیشنیاز برای ایجاد گروههای عاملی و همچنین به عنوان آغازگر برای شروع فرآیند پلیمریزاسیون روی سطح استفاده میشود. مزیت این روش این است که میتوان شیمی و ضخامت باندهای کووالان موجود روی لایه را کنترل کرد. با این حال مشکل عمدهای که در فرآیند پیوند زدن وجود دارد محدودیت در نفوذ به لایههای عمیق میباشد (6).
7 تیمار پلاسما
در این فرآیند برای ایجاد پلاسمای دشارژ برانگیخته از یک لوله که از هر گونه گازی تخلیه شده است، استفاده میشود. این لوله با یک گاز که دارای فشار کم میباشد مانند آرگون، بخار آمونیاک یا اکسیژن پر میشود. برای برانگیختن گازها درون لوله از یک منبع انرژی همانند جریان الکتریکی، گرما، رادیوفرکانس، امواج مایکروویو و یا جریان متناوب و مستقیم استفاده میشود. این جریان سبب یونیزه شدن گازها و تبدیل آنها به رادیکالهای آزاد، یونها، الکترونها، پروتونها، مولکولها و یا اتمهای گازی با انرژی متفاوت شود. در نهایت بمباران سطوح با این گونههای پرانرژی که پلاسما نامیده میشوند سبب انتقال انرژی به سطح سوبسترا میشود به طور کلی فرایند پلاسما برای برداشت یک ماده از سطح و یا نشاندن یک ماده صورت میگیرد. روش تیمار پلاسما شامل دو دسته است: 1) پلاسمای داغ همراه دمای بالا (Thermal/high-temperature/Hot plasma) و 2) پلاسمای سرد همراه دمای پایین (Non thermal/low-temperature/Cold plasma).
روش اول برای مواد حساس به دما همانند پلیمرها مناسب نبوده زیرا باعث تخریب آنها میشود. در حالی که روش دوم این ریسک را کاهش میدهد. اصلاح سطح با روش پلاسما، سبب تشکیل گروههای قطبی آبدوست مانند هیدروکسیل، کربوکسیل، آمین و کربونیل روی سطح میشود. حضور این گروهها سبب افزایش آبدوستی و افزایش زیستسازگاری برای کاربردهای زیست پزشکی میشود. از مزایای این روش میتوان به ساخت لایههای نازک با خواص کاملا متفاوت نسبت به حالت توده آن بدون حضور حلال و با کنترل میزان تخریب این لایههای سطحی اشاره داشت. روش تیمار پلاسما سبب میشود که لایههای نازک به آسانی تخریب شوند و همچنین سبب کاهش خواص مکانیکی ماده (مانند قدرت کشش و مدول الاستیک) میشود.
8 تیمار شیمیایی
تیمار پلاسمایی نانوفیبرها نمیتواند به طور موثر سطوحی از نانوفیبرهایی را که از دسترس خارج هستند، اصلاح کند. زیرا عمق نفوذ پلاسما محدودیت دارد. در نتیجه روش اصلاح شیمیایی به سبب توانایی آن در اصلاح غشاهای نانوفیبر زخیم میتواند تکنیک اصلاح سطح موثرتری باشد. اصلاح شیمیایی میتواند یک و یا بیش از یک نوع گونه شیمیایی روی سطح را به سبب بهبود خواص فیزیکی و شیمیایی آن در واکنش درگیر کند (7). این فرآیند، با فعالسازی سطحی آغاز میگردد. این فعالسازی موجب ایجاد گروههای عاملی روی سطح میشود (8). در این روش، مواد با واکنشگرهایی که در حلال وجود دارد تیمار میشوند. که در نهایت گروههای عاملی روی سطح ایجاد میکند. این روش کلاسیک است و به هیچگونه تجهیزات خاصی نیاز ندارد و در اکثر آزمایشگاهها قابل اجرا است. فرآیند تیمار شیمیایی شامل دو روش زیر میباشد.
8.1 هیدرولیز
اگر هیدرولیز تنها به وسیله آب صورت گیرد، فرآیند بسیار آهسته است. به همین دلیل برای افزایش سرعت واکنش از یک اسید یا باز رقیق شده استفاده میشود (6). در هیدرولیز اسیدی پلیمرهای کاتیونی تولید می-شود در حالی که در هیدرولیز قلیایی پلیمرهایی با گروههای عاملی آمینی آزاد تشکیل میشوند. هیدرولیز قلیایی معمولا موثرتر بوده و تقریبا به طور کامل اتفاق میافتد. در حالی که نیروهای الکترواستاتیک بین گروههای آمینی کاتیونی و پروتونهای هیدراته در محلول مانع هیدرولیز اسیدی به طور کامل میشود. از طرف دیگر در فرآیند هیدرولیز سدیم هیدروکسید و نمک سدیم فومارات، محصولات جانبی باید دیالیز یا رسوب داده شوند برخلاف هیدرولیز اسیدی، همانند مخلوط حلال آبی و متانول که محصول جانبی آن متیل فومارات است و میتواند به راحتی جدا شود (37). در فرآیند هیدرولیز قلیایی پروتونهای کوچک و بسیار متحرک میتوانند بین زنجیرههای مولکولی بدون بار به آسانی منتشر شوند و در نتیجه قادر به ایجاد تخلخل در داریستهای سه بعدی میباشند. یکی از رایجترین هیدرولیزها، هیدرولیز پلیاسترها میباشد که طی هیدرولیز، آب با گروههای استری واکنش داده و گروههای قطبی آبدوست ایجاد میکند. در طی فرآیند هیدرولیز پلیاستر، برش باندهای استری، گروههای کربوکسیل و هیدروکسیل آبدوست ایجاد میکند. این گروههای فعال امکان اتصال کووالان با سایر اجزا را فراهم میآورد (8).
8.2 آمینولیز
آمینولیز یک روش آسان جهت اصلاح سطح پلیمرها است. طی 50 سال گذشته، آمینولیز مولکولهای کوچک استری مورد مطالعه قرار گرفته است. در فرایند آمینولیز، یک حمله نوکلئوفیلی توسط دیآمین به کربن گروه کربونیل دارای پیوند استری روی زنجیره اصلی اتفاق میافتد که سبب شکسته شدن پیوند استری و جدا شدن گروه آلکوکسی میشود و یک حد واسط چهاروجهی حاصل میشود. در این فرایند پیوند آمیدی تشکیل شده و گروههای آمین و هیدروکسیل روی سطح پلیاستر ایجاد میشود که سبب اتصال آسان مولکولهای دیگر به سطح میشود. در روش آمینولیز از دیآمینهایی مثل اتیلن دیآمین، آمینواتیلن پروپان دیآمین، هگزاندیآمین و EDAC)( 1-ethyl-3-(3- dimethyl amino propyl)- carbodi-imide استفاده میشود. در مقایسه با سایر روشهای اصلاح سطح، مثل پلاسما و اکسیداسیون، آمینولیز دارای مکانیسم روشنتر و قابل پیشبینیتری است. همچنین، آمینولیز برای اصلاح سطح داخلی داربستهای سه بعدی در مهندسی بافت مناسب است. یکی دیگر از مزایای این روش این است که همانند پلاسما دارای توانایی کنترل میزان تخریب سطح ماده برای ایجاد گروههای عاملی میباشد. مزیت دیگری که این روش دارد، این است که در این روش لایهها به آسانی شکل و فرم میگیرند و همانطور که گفته شد، بر خلاف روش تیمار پلاسما میتوانند به لایههای عمیق در فیبرهایی با ضخامت بالا نفوذ کنند. از عیوب این روش، میتوان به این موارد همچون خوردگی ایجاد شده روی سطح، بی نظمی و کاهش خواص مکانیکی نانوفیبر اشاره نمود (9).
9 مطالعات قبلی بر اصلاح داربستهای نانوفیبری پلیکاپرولاکتون
در سالهای گذشته مطالعات گوناگونی در زمینه بهبود خواص پلیکاپرولاکتون به عنوان داربست سه بعدی در مهندسی بافت صورت گرفته است. به همین جهت در این مقاله با مروری بر متون و پژوهشهای گذشته، ضمن بررسی آنها، با پیشینه پژوهش های انجام شده در زمینه فرآیند الکتروریسی و ساخت داربست سلولی و همچنین روشهای به کاربرده شده برای اصلاح سطح آشنا خواهیم شد.
مطالعهای در سال 2009 توسط یانگ و همکارانش در مورد تاثیر کیتوزان به عنوان پوشش بر روی نانوفیبرهای پلیکاپرولاکتون جهت تسریع تشکیل بافت استخوانی صورت گرفت. این مطالعه نشان داد بسیاری از خصوصیاتی که داربست پلیکاپرولاکتون از خود بروز میدهد به درصد کیتوزان موجود در نانوفیبرهای پلیکاپرولاکتون وابسته است. همانطور که در این مطالعه نشان داده شد، افزایش درصد کیتوزان موجب شد که قطر نانوفیبرهای پلیکاپرولاکتون کاهش یابد، همچنین نانوفیبرها دارای سطحی صاف شوند و نیز موجب افزایش ترشوندگی نانوفیبرهای پلیکاپرولاکتون شد. به طور کلی حضور کیتوزان سبب افزایش سرعت رشد و تکثیر سلولهای استخوانی شد و در غلظتهای بالا (9%) تفاوت مورفولوژی چشمگیری در سلولها وجود نداشت (10).
در مطالعه دیگر که در سال 2007 توسط آروج و همکارانش صورت گرفت، نانوفیبرهای پلیکاپرولاکتون به وسیله فرآیند هیدرولیز قلیایی با استفاده از محلول سدیم هیدروکساید، تیمار شدند. سپس لایههای کلسیم فسفات روی سطح آن متصل کردند. در این فرایند، اتصال کلسیم فسفات به سطح نانوفیبرهای پلیکاپرولاکتون سبب پیشرفت و بهبود تکثیر استخوانسازی بر روی این داربست شد (11).
در تحقیقی که بر روی داربست پلیکاپرولاکتون برای ساخت بافت غضروف صورت گرفت، از پلیمر طبیعی هیالورونیک اسید به عنوان پوششی برای داربست پلیکاپرولاکتون به جهت بهبود استحکام مکانیکی وتحریک کندروسیتها استفاده شد. نتایج حاکی از آن بود که این داربست، علاوه بر آبدوست بودن، موجب بیان بیشتر گیرنده CD44 به علت حضور هیالورونیک اسید میشود. زیرا گیرندههای سطحی CD44 تمایل دارند به هیالورونیک اسید اتصال پیدا کنند، که این اتصال سبب فعال شدن آبشاری درون سلول میشود که در نهایت منجر به تکثیر کندروسیتها میشود (12).
در سال 2013 مطالعهای روی داربست پلیکارولاکتون صورت گرفت، داربستهای متخلخل پلیکاپرولاکتون با هیالورونیک اسید پوشش داده شدند. این کار سبب ایجاد محیط بیولوژیکی شد که امکان ساخت و بازتولید سلولهای غضروف مفصلی در آن فراهم شد. در نتیجه وجود این داربست سبب بهبود رشد و تکثیر سلولها گشت و در این مطالعه از این داربست برای ترمیم آسیبهای غضروفی زانو استفاده کردند که نتایج خوبی به همراه داشت (13).
در مورد دیگری نانوفیبرهای پلیکاپرولاکتون طی فرآیند آمینولیز اصلاح سطح شده و روی آنها کلاژن اتصال پیدا کرد. این مطالعه نشان داد که پلیکاپرولاکتون اصلاح شده میتواند یک داربست مناسب برای محدوده وسیعی از کاربردهای مهندسی بافت باشد. در این مطالعه نشان داده شد که معایب پلیکاپرولاکتون از جمله هیدروفوبیسیتی و زیستسازگاری کم آن، به وسیله اصلاح سطح طی فرآیند آمینولیز و اتصال کلاژن بهبود پیدا کرد (14).
تحقیقی توسط کروزیر و همکارانش در سال 2014 انجام شد، طی آن محققان، نانوفیبر پلیکاپرولاکتونی ساختند که روی سطح آن را با پلیساکاریدها پوشش دادند. این پلیساکاریدها که کیتوزان و هیالورونیک اسید بودند به صورت لایه لایه روی نانوفیبرها قرار داده شدند. کاربردی که برای آن در نظر گرفتند، ترمیم زخم بود. پوشش ایجاد شده سبب بهبود خواص سطحی نانوفیبر شده ولی بهترین حالتی که سلولها بتوانند روی آن رشد کنند، وجود یک لایه کیتوزان روی سطح بود (15).
مطالعهای در سال 2010 توسط چن و همکاران صورت پذیرفت. در این مطالعه کامپوزیت پلیکاپرولاکتون و پلیایزوپروپیل آکریلامید توسط فرایند الکتروریسی ایجاد شدند که پلیکاپرولاکتون به عنوان هسته و پلیایزوپروپیل آکریلامید به عنوان پوشش مورد استفاده قرار گرفتند. اعتقاد برآن است که به علت زیست تخریبپذیری و خاصیت حساس به دمای پلیمر پلیایزوپروپیل آکریلامید، بتوان از این کامپوزیت فیبری هسته-پوسته، در دارورسانی، مهندسی بافت و کاربردهای زیستی استفاده کرد (16).
در مطالعهای که در سال 2020 توسط عسگری و محمودیفرد انجام شد، پلیمر طبیعی هیالورونیک اسید به صورت پوسته بر روی هسته از جنس پلیمر پلیکاپرولاکتون با روش الکتروریسی دو نازل اتصال پیدا کرد. این تحقیق به منظور ساخت داربستی که خواص آن با استفاده از پلیمر هیالورونیک اسید برای به دام انداختن و اتصال بهتر سلولهای توموری به آن بهبود یافته، انجام گردید. نتایج حاصل از این پژوهش نشان داد که پروتئوگلیکان CD44 سلولهای توموری با گیرنده هیالورونیک اسید اتصال برقرار میکند، بنابراین استفاده از پلیمر هیالورونیک اسید علاوه بر افزایش آبدوستی، سبب اتصال سلولهای توموری نیز میشود که CD44 روی آنها بیش از حد بیان میگردد. بنابراین استفاده از پلیمر هیالورونیک اسید سبب بهبود این اتصال و به دام انداختن بیشتر سلولهای توموری گردید (17).
در مطالعه دیگری که توسط تولدو و همکارانش در سال 2020 انجام شد، از سیستم حلال شیمیایی به جهت بهبود اتصال سلولی استفاده گردید. در این پژوهش اثر سه نوع دیآمین بر روی نانوفیبر نانوفیبرها مورد بررسی قرار گرفت. نتایج حاکی از آن بود که استفاده از مولکولهای دیآمین موجب آمینه شدن سطح و در نهایت موجب بهبود اتصال و چسبندگی سلولی در استفاده از هر سه نوع دیآمین گردید (18).
در سال2020 تحقیقی توسط آمورس دسوسا و همکارانش بر روی اثر اتصال پروتئین در پی آمینولیز نانوفیبرهای پلیکاپرلاکتون بر سلولهای بنیادی عصبی صورت گرفت. در این پژوهش برای اتصال پروتئینها به سطح آمینولیزشده از لینکر گلوتارآلدهید استفاده گردید. سلولهای بنیادی در پی این اصلاح سطح، تکثیر و چسبندگی بهتری از خود نشان دادند (19).
نتیجه گیری
نانوفیبرهای پلی کاپرولاکتون به دلیل دارا بودن ویژگی های فیزیکی و استحکامی مناسب کاربردهای گسترده ای در مهندسی بافت یافته اند. اما استفاده از این پلیمری در فناوری های زیست پزشکی به دلیل آبدوستی پایین محدود می شود. پلیمرهای آبگریز به دلیل ترشوندگی اندک نمی توانند بستر مناسبی جهت اتصال سلول ها فراهم آورند. فناوری اصلاح سطح یکی از روش های امید بخش جهت بهبود کارایی نانوفیبر های پلی کاپرولاکتون است که می تواند کارایی این پلیمر را در ساخت نانوفیبرهای مهندسی بافت افزایش دهد.
تشکر و قدردانی
این مطالعه تحت حمایت دانشگاه علوم پزشکی شیراز به انجام رسیده است.
فهرست منابع
-
- Ma Z, Kotaki M, Inai R, Ramakrishna S. Potential of nanofiber matrix as tissue-engineering scaffolds. Tissue engineering. 2005;11(1-2):101-9.
- Li WJ, Shanti RM, Tuan RS. Electrospinning technology for nanofibrous scaffolds in tissue engineering. Nanotechnologies for the Life Sciences: Online. 2007;9.
- Xue J, Xie J, Liu W, Xia Y. Electrospun nanofibers: new concepts, materials, and applications. Accounts of chemical research. 2017;50(8):1976-87.
- Zhang Y, Venugopal J, Huang Z-M, Lim C, Ramakrishna S. Characterization of the surface biocompatibility of the electrospun PCL-collagen nanofibers using fibroblasts. Biomacromolecules. 2005;6(5):2583-9.
- Cipitria A, Skelton A, Dargaville T, Dalton P, Hutmacher D. Design, fabrication and characterization of PCL electrospun scaffolds—a review. Journal of Materials Chemistry. 2011;21(26):9419-53.
- Salles Kurusu R. Polymer blending as a surface modification technique to alter the wettability of hydrophobic electrospun mats: École de technologie supérieure; 2016.
- Hilal N, Khayet M, Wright CJ. Membrane modification: Technology and applications: CRC press; 2012.
- Katti DS, Vasita R, Shanmugam K. Improved biomaterials for tissue engineering applications: surface modification of polymers. Current topics in medicinal chemistry. 2008;8(4):341-53.
- Zhu Y, Mao Z, Gao C. Aminolysis-based surface modification of polyesters for biomedical applications. RSC advances. 2013;3(8):2509-19.
- Yang X, Chen X, Wang H. Acceleration of osteogenic differentiation of preosteoblastic cells by chitosan containing nanofibrous scaffolds. Biomacromolecules. 2009;10(10):2772-8.
- Araujo J, Martins A, Leonor I, Pinho ED, Reis R, Neves N. Surface controlled biomimetic coating of polycaprolactone nanofiber meshes to be used as bone extracellular matrix analogues. Journal of Biomaterials Science, Polymer Edition. 2008;19(10):1261-78.
- Lebourg M, Rochina JR, Sousa T, Mano J, Ribelles JLG. Different hyaluronic acid morphology modulates primary articular chondrocyte behavior in hyaluronic acid‐coated polycaprolactone scaffolds. Journal of Biomedical Materials Research Part A. 2013;101(2):518-27.
- Lebourg M, Martínez-Díaz S, García-Giralt N, Torres-Claramunt R, Ribelles JG, Vila-Canet G, et al. Cell-free cartilage engineering approach using hyaluronic acid–polycaprolactone scaffolds: a study in vivo. Journal of biomaterials applications. 2014;28(9):1304-15.
- Krithica N, Natarajan V, Madhan B, Sehgal PK, Mandal AB. Type I collagen immobilized poly (caprolactone) nanofibers: Characterization of surface modification and growth of fibroblasts. Advanced Engineering Materials. 2012;14(4):B149-B54.
- Croisier F, Atanasova G, Poumay Y, Jérôme C. Polysaccharide‐coated PCL nanofibers for wound dressing applications. Advanced healthcare materials. 2014;3(12):2032-9.
- Chen M, Dong M, Havelund R, Regina VR, Meyer RL, Besenbacher F, et al. Thermo-responsive core− sheath electrospun nanofibers from poly (N-isopropylacrylamide)/polycaprolactone blends. Chemistry of Materials. 2010;22(14):4214-21.
- Asghari S, Mahmoudifard M. Core‐shell nanofibrous membrane of polycaprolactone‐hyaluronic acid as a promising platform for the efficient capture and release of circulating tumor cells. Polymers for Advanced Technologies. 2021;32(3):1101-13.
- Toledo A, Ramalho B, Picciani P, Baptista L, Martinez A, Dias M. Effect of three different amines on the surface properties of electrospun polycaprolactone mats. International Journal of Polymeric Materials and Polymeric Biomaterials. 2021;70(17):1258-70.
- Amores de Sousa MC, Rodrigues CA, Ferreira IA, Diogo MM, Linhardt RJ, Cabral J, et al. Functionalization of electrospun nanofibers and fiber alignment enhance neural stem cell proliferation and neuronal differentiation. Frontiers in bioengineering and biotechnology. 2020:1215.